
【题目】铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是( )
A. 稀硫酸 B. CuSO4 C. AgNO3 D. Fe2(SO4)3
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
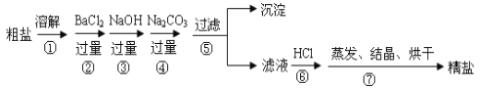
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________________________。
(2)第②步操作的目的是除去粗盐中的__________(填化学式),判断BaCl2已过量的方法是____________________________________________________________。
(3)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是________________。
(4)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、________、__________。
(5)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、酒精灯、火柴、玻璃棒、______。
(6)第④步除原食盐中杂质离子与碳酸根的反应外还有的反应的离子方程式为:______________________________;
(7)第⑥步操作中涉及反应的离子方程式有:__________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表中短周期的一部分。已知a原子的最外层上的电子数目是次外层电子数目的一半,下列说法中不正确的是( )

A. 元素a的最高价氧化物的水化物的酸性比b弱
B. 元素a的原子半径比d的大
C. 元素a的单质在空气中燃烧会导致“温室效应”
D. 元素a单质是一种良好的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子的认识正确的是( )
A.原子是构成一切物质的最小微粒
B.原子是不可再分的一种微粒
C.原子是化学变化中的最小微粒
D.所有原子的原子核内均有质子和中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(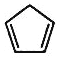 )是一种重要的化工原料。
)是一种重要的化工原料。
(1)工业上可用环戊二烯制备金刚烷
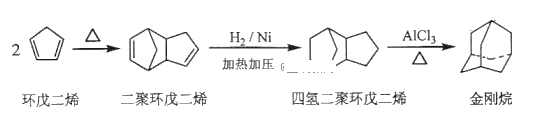
①环戊二烯分子中最多有_____________个原子共平面;
②金刚烷的分子式为___________,其二氯代物有________种。
③已知烯烃能发生如下反应:
![]()
请写出下列反应产物的结构简式:__________
![]()
(2)Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是 由环戊二烯和A经Diels-Alder反应制得
由环戊二烯和A经Diels-Alder反应制得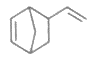 。
。
①Diels-Alder反应属于_______反应(填反应类型):A的结构简式为________________。
②写出与 互为同分异构,且一溴代物只有两种的芳香烃的名称_______,
互为同分异构,且一溴代物只有两种的芳香烃的名称_______,
写出生成这两种一溴代物所需要的反应试剂和反应条件_______________、______________。
③写出实验室由![]() 的属于芳香烃的同分异构体的同系物制备
的属于芳香烃的同分异构体的同系物制备 的合成路线流程图,合成路线流程图示例如下:
的合成路线流程图,合成路线流程图示例如下:
![]()
_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的离子方程式正确的是( )
A. 2Na+3H+=2Na++H2↑
B. Na+H2O=Na++OH-+H2↑
C. 2Na+2H2O=2Na++2OH-+H2↑
D. 2Na+2H2O=2Na++O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题。
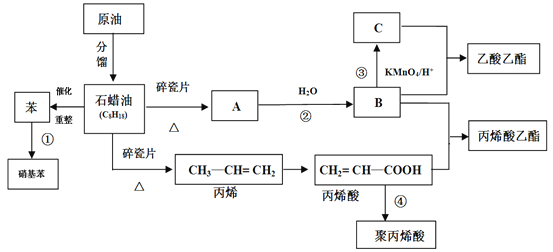
(1)A的结构简式为________。
(2)丙烯酸中含氧官能团的名称为_______。
(3)①③反应的反应类型分别_______、_______。
(4)写出下列反应方程式
①反应②的方程式_____________________;
②反应④的方程式_____________________;
③丙烯酸+B→丙烯酸乙酯________________。
(5)丙烯酸(CH2=CH—COOH)的性质可能有_______
①加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
A.只有①③ B.只有①③④
C.只有①③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)![]() H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
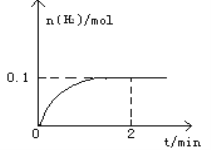
(1)2 min时HI的转化率a(HI)=____________________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________________。
2HI(g)的平衡常数K=________________。
(2)下列哪种情况能说明该反应已经达到平衡状态(___________)
A.气体的密度不再变化了
B.气体的颜色不再变化了
C.气体的总压强不再变化了
D.相同时间内消耗氢气的质量和生成碘的质量相等
E.单位时间内消耗氢气和消耗碘化氢的物质的量相等
F.氢气的质量分数不变了
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) ![]() 2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
反应达到平衡状态,测得体系压强升高。该反应△H____0(填“>”、“<” 或者“=”),简述该反应的平衡常数与温度的变化关系:__________________________________________________。
(4)该反应如果把D的物质的量增大一倍,逆反应速率________(填“增大”、“减小” 或者“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com