
����Ŀ����ҵ�кܶ���Ҫ��ԭ�϶�����Դ��ʯ�ͻ������ش��������⡣
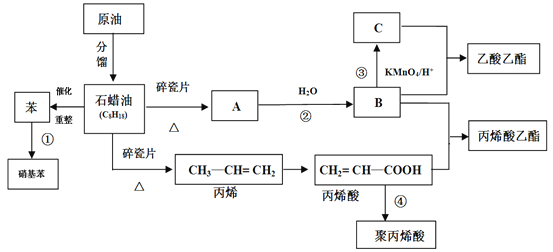
(1)A���ṹ��ʽΪ________��
(2)��ϩ�������������ŵ�����Ϊ_______��
(3)�٢۷�Ӧ�ķ�Ӧ���ͷֱ�_______��_______��
(4)д�����з�Ӧ����ʽ
�ٷ�Ӧ�ڵķ���ʽ_____________________��
�ڷ�Ӧ�ܵķ���ʽ_____________________��
�۱�ϩ��+B����ϩ������________________��
(5)��ϩ��(CH2=CH��COOH)�����ʿ�����_______
�ټӳɷ�Ӧ ��ȡ����Ӧ �ۼӾ۷�Ӧ ���кͷ�Ӧ ��������Ӧ
A��ֻ�Т٢� B��ֻ�Т٢ۢ�
C��ֻ�Т٢ۢܢ� D���٢ڢۢܢ�
���𰸡�CH2=CH2 �Ȼ� ȡ����Ӧ ������Ӧ CH2=CH2+H2O![]() CH3CH2OH nH2C=CH-COOH��
CH3CH2OH nH2C=CH-COOH��![]() CH2=CH��COOH+CH3CH2OH
CH2=CH��COOH+CH3CH2OH![]() CH2=CH��COOC2H5+H2O D
CH2=CH��COOC2H5+H2O D
��������
��ͼ��ת����ϵ��֪��B��������C���Ҷ��߷�Ӧ����������������BΪCH3CH2OH��CΪCH3COOH����A��ˮ������Ӧ�õ��Ҵ�����AΪCH2=CH2���Ҵ����ϩ�ᷢ��������Ӧ���ɱ�ϩ����������ϩ�ᷢ���Ӿ۷����ɾ۱�ϩ�ᣬ����Ũ������Ũ���������������������·���ȡ����Ӧ�������������Դ˷������
(1)������������֪��AΪCH2=CH2���ʴ�Ϊ��CH2=CH2��
(2)��ϩ���к���������Ϊ-COOH������Ϊ�Ȼ����ʴ�Ϊ���Ȼ���
(3)��Ӧ��Ϊ����������Ӧ����Ӧ��Ϊ�Ҵ���������Ӧ���ʴ�Ϊ��ȡ����Ӧ��������Ӧ��
(4)��Ӧ��Ϊ��ϩ��ˮ�ļӳɷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪCH2=CH2+H2O ![]() CH3CH2OH����Ӧ�ܱ�ϩ�ᷢ���ľۺϷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪnH2C=CH-COOH��
CH3CH2OH����Ӧ�ܱ�ϩ�ᷢ���ľۺϷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪnH2C=CH-COOH��![]() ����ϩ�����Ҵ�����������Ӧ���ɱ�ϩ����������Ӧ�Ļ�ѧ����ʽΪCH2=CH-COOH+CH3CH2OH
����ϩ�����Ҵ�����������Ӧ���ɱ�ϩ����������Ӧ�Ļ�ѧ����ʽΪCH2=CH-COOH+CH3CH2OH![]() CH2=CH-COOC2H5+H2O���ʴ�Ϊ��CH2=CH2+H2O
CH2=CH-COOC2H5+H2O���ʴ�Ϊ��CH2=CH2+H2O ![]() CH3CH2OH��nH2C=CH-COOH��
CH3CH2OH��nH2C=CH-COOH��![]() ��CH2=CH-COOH+CH3CH2OH
��CH2=CH-COOH+CH3CH2OH![]() CH2=CH-COOC2H5+H2O��
CH2=CH-COOC2H5+H2O��
(5)��ϩ��(CH2=CH-COOH)�к�̼̼˫�����ɷ����ӳɷ�Ӧ��������Ӧ���Ӿ۷�Ӧ����-COOH���ɷ���ȡ����Ӧ���кͷ�Ӧ���ʴ�Ϊ��D��


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
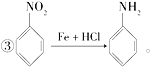
����Ŀ����֪����R��Br�D��R��OH(R��ʾ����)��
�ڱ�����ԭ�е�ȡ�������µ����ȡ�������뱽����λ����������Ӱ�죻
�������ñ���Ϊԭ���Ʊ�һϵ�л������ת����ϵͼ��
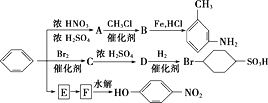
(1)д��Aת��ΪB�Ļ�ѧ����ʽ��______________________��
(2)ͼ�б�ת��ΪE��Eת��ΪFʡ������������д��E��F�Ľṹ��ʽ��
E________________��F_____________________��
(3)B�����б����ϵ����������ⱻ��ԭ��ȡ���õ��Ķ��������____��ͬ���칹�塣
(4)����ת�����漰��9����Ӧ�����в�����ȡ����Ӧ�Ĺ���_____����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƭ����������Һ�У���Ӧʱ������ų���ȡ������Ƭ�������ᣬ�����Һ�ǣ� ��
A. ϡ���� B. CuSO4 C. AgNO3 D. Fe2(SO4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵķ����仯˵����ȷ����
A. Na2CO3��BaCl2�dz�����ǿ����ʣ�������ˮʱ�����ƻ�ˮ�ĵ���ƽ��
B. NO2�����¼�ѹ������ɫҺ��Ϊ�����仯��NO2��ˮ�ռ�����ɫ����Ϊ��ѧ�仯
C. Na2OSiO2��һ�ּĹ����Σ�¶���ڿ����л����
D. ֲ���Ϳ���ȡ��ˮ�е����ʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش����⣺
(1)��Zn��CuΪ�缫��ϡH2SO4Ϊ�������Һ�γɵ�ԭ����У�
��H+��______���ƶ�(����������������)��
����������������_____������______��(���������������)��
������1mol e���������ߣ��������ϸ�����������______g��
������ϡ���ỻ������ͭ��Һ���缫�������ӵ���_____(����п��������ͭ����)��ԭ����_______(�õ缫����ʽ��ʾ)��
(2)����ȼ�ϵ����һ�ָ�Ч����Ⱦ����������ּ���(��KOH�������)������(�������������)ȼ�ϵ�ء�����Ǽ���ȼ�ϵ�أ���������Ӧ����ʽ��_____��
(3)һ���¶��£����ݻ�Ϊ2L���ܱ������н��з�Ӧ��aN(g)![]() bM(g)��cP(g)��M��N��P�����ʵ�����ʱ��仯��������ͼ��ʾ��
bM(g)��cP(g)��M��N��P�����ʵ�����ʱ��仯��������ͼ��ʾ��
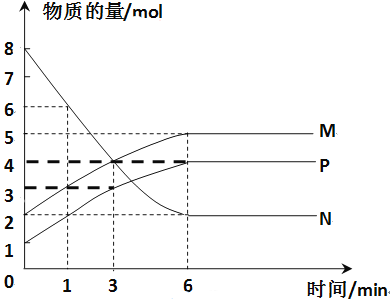
����Ӧ��ѧ����ʽ�и����ʵ�ϵ����Ϊa��b��c��____��
��1 min��3 min���ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��______��
��������������˵��������Ӧ�ﵽƽ��״̬����_____��
A����Ӧ�е�M��N�����ʵ������ʱ
B��P����������ʱ��仯���仯
C���������������ʵ�������ʱ��仯���仯
D����λʱ����ÿ����a mol N��ͬʱ����b mol M
E����������ѹǿ����ʱ��ı仯���仯
F��M�����ʵ���Ũ�ȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ����(����)
A. HCl��NaOH��Ӧ���к�����H=��57.3 kJ��mol-1![]() ����H2SO4��Ca(OH)2��Ӧ���к�������H=2��(��57.3)kJ��mol-1
����H2SO4��Ca(OH)2��Ӧ���к�������H=2��(��57.3)kJ��mol-1
B. 1 mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ����
C. ��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D. CO(g)��ȼ������283.0 kJ��mol-1![]() ����2CO2(g)====2CO(g)+O2(g)��Ӧ����H=+566.0 kJ��mol-1
����2CO2(g)====2CO(g)+O2(g)��Ӧ����H=+566.0 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ�������ж���ȷ����
A. �����£�pH��1��������Һ�У���ˮ�����H������Ϊ10��13NA
B. ��״���£���ԭ������Ϊ0.2NA��CO2��NO2�Ļ�����壬�����Ϊ2.24L
C. �����£�5.6g���ֱ�������������Ũ���ᷴӦ��ת�Ƶĵ�����Ŀ��Ϊ0.3NA
D. 100g46%�������������Ҵ���Һ������O��H��ĿΪ7NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1����ӦA(g)+B(g)![]() C(g)+D(g)�����е������仯��ͼ ��ʾ���жϸ÷�Ӧ��H___________0 (�������������������ȷ����)��
C(g)+D(g)�����е������仯��ͼ ��ʾ���жϸ÷�Ӧ��H___________0 (�������������������ȷ����)��
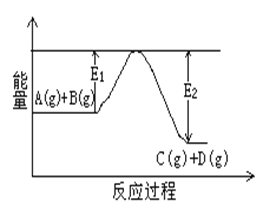
��2����Al2O3��Ni������̬���ᷢ�����з�Ӧ��
����(g)= CO (g)+ H2O (g)�� ��H1= + 34.0 kJ/mol
����(g)= CO2 (g)+ H2(g) ��H2= ��7.0 kJ/mol
�����ķ���ʽΪ____________���ڸ������£���̬CO2 ����̬H2 ������̬CO����̬H2O���Ȼ�ѧ����ʽΪ __________________________________________________________________��
��3������ƽ�����ʢ��ǿ��ԭ��Һ̬��(N2H4)��ǿ������Һ̬˫��ˮ(H2O2)������0.4molҺ̬�º�0.8mol Һ̬H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ������(�൱��25�桢101 kPa�²�õ�����)����Ӧ���Ȼ�ѧ����ʽΪ��____________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��BΪ���ʣ�CΪ�������ʵ������ת����ϵ���ǣ� ��
![]()
����C����ˮ��õ�ǿ����Һ����A������Na
����C��Һ��Na2CO3�ų�CO2���壬��A������H2
����C��Һ�еμ�KSCN��Һ�Ժ�ɫ����B����ΪFe
����C��Һ�еμ�NaOH��Һ����ɫ�������ɣ���B����ΪCu
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com