
����Ŀ���ش��������⣺
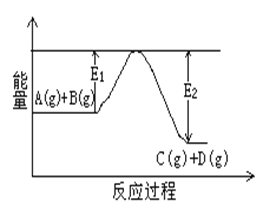
��1����ӦA(g)+B(g)![]() C(g)+D(g)�����е������仯��ͼ ��ʾ���жϸ÷�Ӧ��H___________0 (�������������������ȷ����)��
C(g)+D(g)�����е������仯��ͼ ��ʾ���жϸ÷�Ӧ��H___________0 (�������������������ȷ����)��
��2����Al2O3��Ni������̬���ᷢ�����з�Ӧ��
����(g)= CO (g)+ H2O (g)�� ��H1= + 34.0 kJ/mol
����(g)= CO2 (g)+ H2(g) ��H2= ��7.0 kJ/mol
�����ķ���ʽΪ____________���ڸ������£���̬CO2 ����̬H2 ������̬CO����̬H2O���Ȼ�ѧ����ʽΪ __________________________________________________________________��
��3������ƽ�����ʢ��ǿ��ԭ��Һ̬��(N2H4)��ǿ������Һ̬˫��ˮ(H2O2)������0.4molҺ̬�º�0.8mol Һ̬H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ������(�൱��25�桢101 kPa�²�õ�����)����Ӧ���Ȼ�ѧ����ʽΪ��____________________________________________________________________________��
���𰸡���CH2O2CO2 (g)+H2(g) ![]() CO(g)+H2O (g) ��H= + 41.0 kJ/molN2H4 (l)+2H2 O2 (l)
CO(g)+H2O (g) ��H= + 41.0 kJ/molN2H4 (l)+2H2 O2 (l) ![]() N2(g)+4H2O (g) ��H= -641.75 kJ/mol
N2(g)+4H2O (g) ��H= -641.75 kJ/mol
��������
��1����ͼ����Կ�����Ӧ�����������������������������÷�Ӧ������ӦΪ���ȷ�Ӧ����H��0����2�����������غ㣬�ɼ���(g)= CO (g)+ H2O (g)��֪������ķ���ʽΪCH2O2����֪���ټ��ᣨg��=CO ��g��+H2O ��g����H1=+34.0kJ/mol���ڼ��ᣨg��=CO2 ��g��+H2��g����H2=-7.0kJ/mol����̬CO2����̬H2 ������̬CO����̬H2O�Ļ�ѧ����ʽΪCO2��g��+H2��g��=CO��g��+H2O��g�����Ը��ݢ�-�ڵõ������ԡ�H=34.0kJ/mol-��-7.0kJ/mol��=+41.0kJ/mol����CO2��g��+H2��g��=CO��g��+H2O��g����H=+41.0kJ/mol����3��0.4molҺ̬�º�0.8mol Һ̬H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ�������������Ȼ�ѧ����ʽ�����壬1mol�º�˫��ˮ֮�䷴Ӧ��ų�641.75kJ������������N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.75 kJ/mol���ʴ�Ϊ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.75 kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ���ڱ��ж����ڵ�һ���֡���֪aԭ�ӵ�������ϵĵ�����Ŀ�Ǵ���������Ŀ��һ�룬����˵���в���ȷ����( )

A. Ԫ��a������������ˮ��������Ա�b��
B. Ԫ��a��ԭ�Ӱ뾶��d�Ĵ�
C. Ԫ��a�ĵ����ڿ�����ȼ�ջᵼ��������ЧӦ��
D. Ԫ��a������һ�����õİ뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�кܶ���Ҫ��ԭ�϶�����Դ��ʯ�ͻ������ش��������⡣
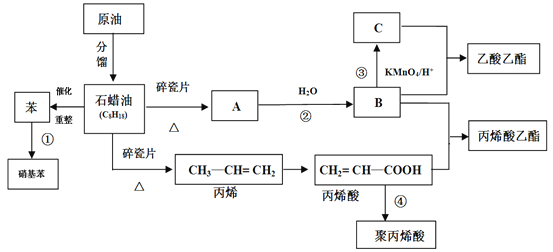
(1)A���ṹ��ʽΪ________��
(2)��ϩ�������������ŵ�����Ϊ_______��
(3)�٢۷�Ӧ�ķ�Ӧ���ͷֱ�_______��_______��
(4)д�����з�Ӧ����ʽ
�ٷ�Ӧ�ڵķ���ʽ_____________________��
�ڷ�Ӧ�ܵķ���ʽ_____________________��
�۱�ϩ��+B����ϩ������________________��
(5)��ϩ��(CH2=CH��COOH)�����ʿ�����_______
�ټӳɷ�Ӧ ��ȡ����Ӧ �ۼӾ۷�Ӧ ���кͷ�Ӧ ��������Ӧ
A��ֻ�Т٢� B��ֻ�Т٢ۢ�
C��ֻ�Т٢ۢܢ� D���٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ձ���ʢ�к�ˮ,�������б���ʴ�ɿ쵽����˳��Ϊ( )

A. �ڢ٢ۢ� B. �ܢۢ٢� C. �ܢڢ٢� D. �ۢڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǿ���С����Ƶ��û�ѧ��ԴʹLED�Ʒ����װ�á�����˵����ȷ����
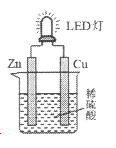
A. ��Һ�е�SO42����ͭ���ƶ�
B. пƬΪԭ��صĸ�����������ԭ��Ӧ
C. �����ϡ���ỻ������֭�������в����е�������
D. ͭƬ�������������ɣ������ķ�ӦΪ��2H++2e����H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Һ��������������Ĺ�ͬ����(����)
A.��ɢ�ʿ���ֱ������l��100 nm֮��
B.��ɫ���ʺ��ɫ
C.һ��ƽ�й�������Һʱ���Ӳ��涼���Կ���һ������
D.���Ƿ�ɢϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�������1L�ܱ������м���1mol HI(g)��������Ӧ2HI(g)![]() H2(g)+I2(g)��H > 0��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
H2(g)+I2(g)��H > 0��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
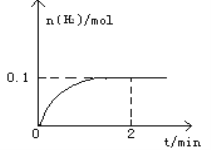
��1��2 minʱHI��ת����a(HI)=____________________�����¶��£�H2(g)+I2(g)![]() 2HI(g)��ƽ�ⳣ��K=________________��
2HI(g)��ƽ�ⳣ��K=________________��
��2���������������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬��___________��
A��������ܶȲ��ٱ仯��
B���������ɫ���ٱ仯��
C���������ѹǿ���ٱ仯��
D����ͬʱ�����������������������ɵ���������
E����λʱ�����������������ĵ⻯������ʵ������
F���������������������ˡ�
��3���ں��ݾ���(������罻������)�����½���2A(g)��B(g) ![]() 2C(g)��D(s)��Ӧ���÷�Ӧ��ƽ�ⳣ���ı���ʽK=____________________,���±�����Ͷ��:
2C(g)��D(s)��Ӧ���÷�Ӧ��ƽ�ⳣ���ı���ʽK=____________________,���±�����Ͷ��:
���� | A | B | C | D |
��ʼͶ��/mol | 2 | 1 | 2 | 0 |
��Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߡ��÷�Ӧ��H____0(�>������<�� ���ߡ�=��),�����÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��__________________________________________________��
��4���÷�Ӧ�����D�����ʵ�������һ�����淴Ӧ����________(���������С�� ���ߡ����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120 mL����0.20 mol̼���Ƶ���Һ��200 mL���ᣬ���ܽ�ǰ�ߵμ�����ߣ����ǽ����ߵμ���ǰ�ߣ�����������������������ɵ����������ͬ���������Ũ�Ⱥ�������( )
A. 2.0 mol��L-1 B. 1.5 mol��L-1 C. 0.18 mol��L-1 D. 0.24 mol��L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӻ������У����������ӵĵ��Ӳ�ṹ��ͬ����(����)
A. NaCl B. LiCl
C. MgO D. Na2S
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com