
【题目】各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )

A. ②①③④ B. ④③①② C. ④②①③ D. ③②④①
【答案】C
【解析】试题分析:①铁为活泼金属,可与稀硫酸发生反应生成氢气,发生化学腐蚀,反应的离子方程式为Fe+2H+═Fe2++H2↑;②B为原电池装置,Fe较活泼为原电池的负极,发生氧化反应被腐蚀,电极方程式为:Fe-2e=Fe2+,Sn为正极,发生还原反应,电极方程式为2H++2e-=H2↑;③Zn比Fe活泼,形成原电池反应,锌被氧化,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,铁做正极被保护,④铁做负极发生氧化反应被腐蚀,电极方程式为Fe-2e=Fe2+,铜做正极;①发生化学腐蚀,②发生电化学腐蚀,③锌比铁活泼,铁做原电池的正极而被保护,④发生电化学腐蚀,其中两个电极活泼些相差越大铁腐蚀速率越大,②④都是铁做负极被腐蚀,④中电极金属活泼性相差大所以腐蚀速率快,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为④>②>①>③,故答案为C。


科目:高中化学 来源: 题型:
【题目】环扁桃酯是用于治疗心脑血管疾病的重要化合物。它的一种合成路线如下
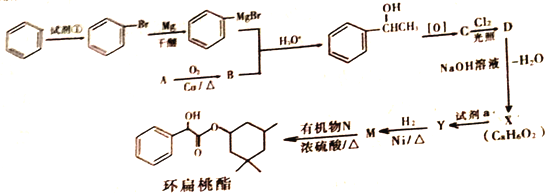
已知: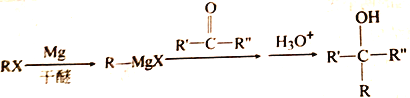 (R、R'、R〞代表烃基或氢)
(R、R'、R〞代表烃基或氢)
(1)试剂①为__________________________;
(2)写出A生成B的反应方程式______________________________;
(3)X的结构简式是______________,X→Y的反应类型是_______________________;
(4)M与N生成环扁桃酯的化学方程式是_______________________;
(5)有机物Z与Y 互为同分异构体,满足下列条件的有机物Z的结构有___________种,写出任意一种核磁共振氢谱中有4个峰,且面积之比为2 :2 :1:1的同分异构体的结构简式为_________________;
①芳香族化合物 ②能发生银镜反应,且1mol与足量的银氨溶液反应生成4molAg
(6)以CH2=CHCH3、CH3CHO为有机原料,结合题目所给信息,选用必要的无机试剂合成CH=CHCH=CHCH3,合成路线为:CH2=CHCH3![]() E
E![]() CH2=CHCH2MgBr
CH2=CHCH2MgBr![]() F
F![]() CH2=CHCH=CHCH3
CH2=CHCH=CHCH3
请依次写出反应①到④反应条件和试剂,写出E、F的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在醋酸的电离平衡中,要使平衡右移且氢离子浓度增大 ,应采取的措施是 ( )
A. 加入氢氧化钠 B. 加入盐酸 C. 向溶液中加水 D. 升高溶液温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。


(1)写出下列仪器的名称:①_______;④ ______
(2)仪器①~④中,使用时必须检查是否漏水的有___________;图I实验过程中使用冷凝管时应从_______处进水。(均填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有________;将仪器补充完整后进行的实验操作的名称为:___________。现需配制500 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液与 5mL 1 mol·L-1 NaNO3 溶液中NO3-物质的量浓度相等的是
A. 10 mL 0.5 mol·L-1 Mg(NO3)2 溶液 B. 25 mL 0.8 mol·L-1 Al(NO3)3 溶液
C. 50 mL 2 mol·L-1 AgNO3 溶液 D. 100 mL 1.0 mol·L-1 Cu(NO3)2 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 甲苯分子中所有原子在同一平面上
B. 苯、乙酸、乙醇均能发生取代反应
C. 分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)
D. 可用溴的四氯化碳溶液区别![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) ![]() CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。

由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是_______________________________________。由图2可知,P点时平衡常数K=______(保留2位有效数字)。Q点转化率高于P点的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)18.6g Na2X含有0.6mol Na+,则X的相对原子质量为_______,该物质的化学式为________。
(2)与0.2mol H2含有相同电子数目的氦气分子的物质的量为__________。
(3)标准状况下,1.6 g某气态氧化物RO2体积为0.56 L,该气体的物质的量为________mol,RO2的相对分子质量为__________。
(4)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75 g/L,该混合气体的平均摩尔质量为__________,该气体对氢气的相对密度为__________,NH3的体积分数为__________。
(5)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(6)相同条件下,H2和O2的体积比为m∶n和质量比为m∶n的混合气体,其平均相对分子质量分别是_______________和______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com