
【题目】氯化铁溶液与氢氧化铁胶体的共同点是( )
A.分散质颗粒直径都在l~100 nm之间
B.颜色都呈红褐色
C.一束平行光照射溶液时,从侧面都可以看到一束光束
D.都是分散系
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
B. 苯、苯酚、己烯只用一种试剂就可以鉴别
C.  用系统命名法叫2-甲基-1-丙醇
用系统命名法叫2-甲基-1-丙醇
D. 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷
的名称为2,5,6-三甲基-4-乙基庚烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1![]() ,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C. 需要加热才能发生的反应一定是吸热反应
D. CO(g)的燃烧热是283.0 kJ·mol-1![]() ,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的结构示意图为 ,由此得到的结论不正确的是
,由此得到的结论不正确的是
A. 该原子有3个电子层B. 该元素属于金属元素
C. 该原子在化学反应中易得2个电子D. 该元素的最高正化合价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H___________0 (填“>”、“<”、“无法确定”)。
C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H___________0 (填“>”、“<”、“无法确定”)。
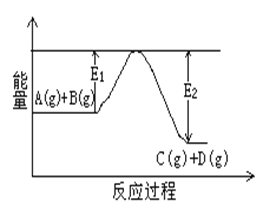
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)= CO (g)+ H2O (g) △H1= + 34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2= —7.0 kJ/mol
则甲酸的分子式为____________,在该条件下,气态CO2 和气态H2 生成气态CO和气态H2O的热化学方程式为 __________________________________________________________________。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2)。当把0.4mol液态肼和0.8mol 液态H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为:____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对突如其来的新冠病毒,许多化学物质发挥了非常重要作用。下列说法正确的是
A.医用酒精灭活新冠肺炎病毒是利用其氧化性
B.N95 口罩所使用的聚丙烯材料属于合成纤维
C.为增强“84”消毒液的消毒效果,可滴加浓盐酸
D.我国研制的重组新冠疫苗无需冷藏保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色溶液中:Ca2+、Cu2+、Br-、Cl- 、
B. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、Cl-、I-
C. 能使酚酞变红的溶液中:K+、Na+、SiO32-、SO42-
D. ![]() =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中进行反应mX(g)+nY(g) ![]() qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的逆反应速率是Y的正反应速率的n/m倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,X的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
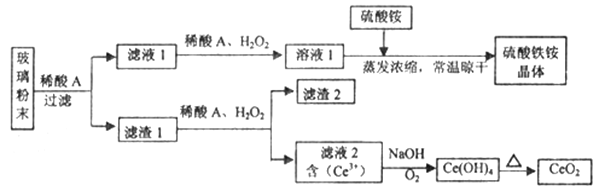
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是____________________________________________________。
(2)设计实验证明滤液1中含有Fe2+__________________________________________________________。
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________________。
(4)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com