
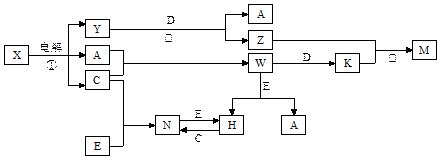
 |
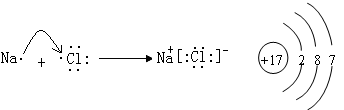
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-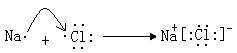 (2)钠在氧气中燃烧生成过氧化钠;(3)Na+,Al3+离子的电子数都是10,质子数越大,半径越小,离子半径:Na+>Al3+,Cl-有三个电子层,半径最大:即Cl->Na+>Al3+.
(2)钠在氧气中燃烧生成过氧化钠;(3)Na+,Al3+离子的电子数都是10,质子数越大,半径越小,离子半径:Na+>Al3+,Cl-有三个电子层,半径最大:即Cl->Na+>Al3+.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
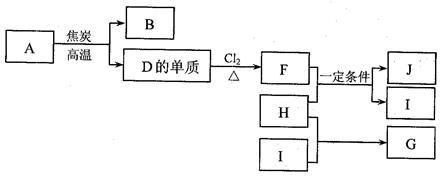
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
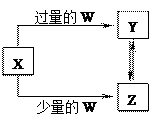
| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | Cl2 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | NaOH | AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
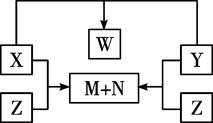
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com