
����Ŀ���±���Ԫ�����ڱ���һ���֣����û�ѧ���Żش��й����⣺
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | |||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� |
��1�����л�ѧ��������õ�Ԫ�أ���ԭ�ӽṹʾ��ͼΪ___��
��2���ڡ��ࡢ�ᡢ������Ԫ�صļ���̬�⻯���ȶ�����ǿ������˳����___������������ˮ������������ǿ����___��
��3����������Ԫ���γɵļ������а뾶��С������___��д����Ԫ�صĵ��ʷֱ���ޡ�������������ˮ���ﷴӦ�����ӷ���ʽ___��___��
��4��Ԫ�آ۵��⻯��ĵ���ʽ��___�����⻯����Ԫ�آ���⻯�����Ӧ�Ļ�ѧ����ʽ___��
��5���õ���ʽ�ֱ�д��Ԫ�آ���Ԫ�آڡ����γɻ��������___��___��
���𰸡�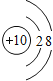 HCl>H2S>CH4>SiH4 HClO4 Al3+ 2Al+2OH+2H2O=2AlO2+3H2�� 2Al+6H+= 2Al3+ +3H2��
HCl>H2S>CH4>SiH4 HClO4 Al3+ 2Al+2OH+2H2O=2AlO2+3H2�� 2Al+6H+= 2Al3+ +3H2�� ![]() NH3+HCl=NH4Cl
NH3+HCl=NH4Cl ![]()
![]()
��������
(1)ϡ�����廯ѧ��������ã����Ի�ѧ��������õ�Ԫ���Ǣݼ�NeԪ�أ���˵����Ϊ10�����������Ϊ10��ԭ�ӽṹʾ��ͼΪ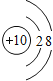 ��
��
(2)�ڡ��ࡢ�ᡢ������Ԫ�طֱ�ΪC��Si��S��Cl���ǽ�����Խǿ����̬�⻯���ȶ���Խǿ������˳��Ϊ��HCl>H2S>CH4>SiH4���ǽ�����Խǿ����������ˮ���������Խǿ������������ǿ����HClO4��
(3)���Ӳ���Խ��뾶Խ���Ӳ�����ͬ�˵����ԽС�뾶ԽС�����Ե�������Ԫ���γɵļ������а뾶��С������Al3+���ޡ�������������ˮ����ֱ�ΪNaOH��HClO4�����������������Ʒ�Ӧ���ӷ���ʽΪ��2Al+2OH+2H2O=2AlO2+3H2����������ᷴӦ�����ӷ���ʽΪ2Al+6H+= 2Al3+ +3H2����
(4)��ΪNԪ�أ��⻯��ΪNH3������ʽΪ![]() ���������Ȼ���ķ�Ӧ����ʽΪ��NH3+HCl=NH4Cl��
���������Ȼ���ķ�Ӧ����ʽΪ��NH3+HCl=NH4Cl��
(5)��ΪSԪ�أ���ΪCԪ�أ���ΪNaԪ�أ�CS2Ϊ���ۻ�������γɹ���Ϊ��![]() ��Na2SΪ���ӻ�������γɹ���Ϊ
��Na2SΪ���ӻ�������γɹ���Ϊ ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ͻ��������������Է�Һ�к������ֽ������ӣ�Fe3����Cu2������ѧС�����������ͼ��ʾ�ķ����Է�Һ���д������Ի��ս���������������
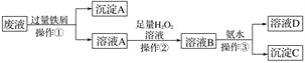
(1)�����ٵ�������________________�� ����A�к��еĽ���������________________��
(2)��ҺA�м���H2O2��Һ�����з�����Ӧ�����ӷ�Ӧʽ________________________________��������Ϊ�������ȱ��£��ڴ˹������¶Ȳ��˹��ߵ�ԭ����________________________________��
(3)������ҺB�к��еĽ��������ӵ�ʵ�鷽��Ϊ��ȡ������ҺB�ڽྻ��С�Թ��У�����______�Լ�����ҺѸ��ת��Ϊ________ɫ�����ɼ��顣
(4)�������з�����Ӧ�����ӷ���ʽΪ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����H2(g)+![]() O2(g)=H2O(g) ��H1=-241.8kJ��mol-1��
O2(g)=H2O(g) ��H1=-241.8kJ��mol-1��
��H2(g)+![]() O2(g)=H2O(l) ��H2=-285.8kJ��mol-1��
O2(g)=H2O(l) ��H2=-285.8kJ��mol-1��
��̬�����еĻ�ѧ�� | �Ͽ�1mol��ѧ�����������/kJ |
O��H | 465 |
O=O | 498 |
����˵������ȷ���ǣ� ��
A.������ȼ���Ȧ�H=-241.8kJ��mol-1
B.�Ͽ�1molH��H����Ҫ����439.2kJ������
C.��ͬ�����£�1molH2O(g)��1molH2O(l)������
D.18gH2O(l)��ȫ�ֽ�������������������Ҫ����285.8kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ѿ����ֵ�һ�ٶ���Ԫ���У���ϡ�������⣬�ǽ���Ԫ��ֻ��ʮ���֣������������������е���ϵ��
��1���������п������뵼����ϵ�Ԫ�ص�������������ռ���Һ��Ӧ�����ӷ���ʽ�ǣ�__________��
��2��Ϊ�����ú�������ʣ�������������Һ��������һ��Һ���ǽ������õ���������һ����̼�ڴ���������ת��Ϊ�״���д���û�ѧ��Ӧ����ʽΪ____________��
��3�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ϳɰ��ķ�Ӧ����������ʳ�����Ӧ���£�N2(g)��3H2(g)![]() 2NH3(g)��
2NH3(g)��
�ٺϳɰ��ķ�Ӧ�е������仯��ͼ��ʾ���÷�Ӧ��________��Ӧ������ȡ����ȡ�����

����һ�������£���2.5mol N2��7.5mol H2�Ļ������������Ϊ2L�Ĺ̶��������з�����Ӧ��N2��g��+ 3H2(g) ![]() 2NH3(g)��5����ĩʱ�ﵽƽ�⣬��������ڵ�ѹǿ�ǿ�ʼʱ��0.9������5�������ð�����ʾ�÷�Ӧ��ƽ����ѧ��Ӧ����Ϊ��V(NH3)=____________�������ﵽƽ��ʱ��ת������_____________������С�����һλ����
2NH3(g)��5����ĩʱ�ﵽƽ�⣬��������ڵ�ѹǿ�ǿ�ʼʱ��0.9������5�������ð�����ʾ�÷�Ӧ��ƽ����ѧ��Ӧ����Ϊ��V(NH3)=____________�������ﵽƽ��ʱ��ת������_____________������С�����һλ����
��4����������������ɴ���ʹ����һ������װ�ã��乹����ͼ��ʾ��

A��B�����缫���ɶ��̼����ɡ��õ�ص�������ӦʽΪ��________________����������װ���е��������ɼ��飬������ı䣬��Ӧװ�õĸ�����Ӧ����ʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�����Ҫ���л�����ԭ�ϣ�������ϩˮ�Ϸ���������Ӧ�Ļ�ѧ����ʽ���£�C2H4(g)+ H2O(g)![]() C2H5OH(g)����ͼΪ��ϩ��ƽ��ת�������¶�(T)��ѹǿ(P)�Ĺ�ϵ[��ʼn(C2H4)��n(H2O) =1��1]�������й�������ȷ����
C2H5OH(g)����ͼΪ��ϩ��ƽ��ת�������¶�(T)��ѹǿ(P)�Ĺ�ϵ[��ʼn(C2H4)��n(H2O) =1��1]�������й�������ȷ����
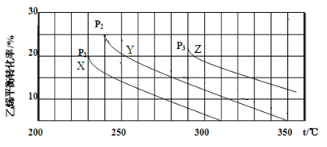
A. Y��Ӧ���Ҵ�����������Ϊ1/9
B. X��Y��Z��Ӧ�ķ�Ӧ���ʣ���(X) > ��(Y) > ��(Z)
C. X��Y��Z��Ӧ��ƽ�ⳣ����ֵ��KX > KY > KZ
D. ����ѹǿ�������¶Ⱦ��������ϩ��ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬѧ��ͨ��ʵ��̽��ͬ����Ԫ�����ʵĵݱ���ɣ��Լ�Ӱ�컯ѧ��Ӧ���ʵ����ء�����Ƶ�ʵ�鷽�����£����������д���������������ۡ�
ʵ�����ṩ���Լ���п�顢п�ۡ����������ۡ�ͭ����NaBr��Һ��NaI��Һ�����Ƶ���ˮ��1mol/���ᡢ3mol/L������
��1��̽��ͬ����Ԫ�����ʵĵݱ����
ʵ�鲽�� | ʵ������ | ʵ����ۼ����ӷ�Ӧ����ʽ |
| �ף�___ �ң�___ | ���ӷ�Ӧ����ʽ �ף�___ �ң�___ ���ۣ�±�ص��ʵ���������ǿ������˳��ΪCl2��Br2��I2 |
���ۣ���ͬѧ��Ƶ�ʵ�鷽���ĺ�������___������ţ�
A.�dz����� B.��ȫ������ C.���ֺ���
��������ƣ���һ������A������������������B��C�������ʵ�黹��Ҫ���Լ����йط�Ӧ�����ӷ�Ӧ����ʽΪ��___��
��2��̽��Ӱ�컯ѧ��Ӧ���ʵ�����
ʵ�鲽�� | ʵ������ | ʵ�����ݺͽ��� |
������������ͬ������������� | �����������ɣ�п������ʧ��п�����ʧ | ��Ϊ���Թ��еķ�Ӧ���죬���Է�Ӧ��Ũ��Խ��Ӧ����Խ�졣 |
��ͬѧ����ʵ�����ݺͽ������������⣬������___��
��3����������ԭ���ԭ�������ʵ�飬�Ƚ�ͭ�����Ľ�����ԡ�����ʵ��װ��ͼ�������������������������___��д���缫��Ӧʽ���缫��Ӧʽ��____��____��
װ��ͼ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽��������ˮ�ɷּ����ʵ�ʵ���У��������з����������ܵó���Ӧ���۵��ǣ� ��
ѡ�� | ���� | ���� | ���� |
A | �۲���ˮ��ɫ | ��ˮ�ʻ���ɫ | ��ˮ�к�Cl2 |
B | ��NaHCO3��Һ�м���������ˮ | ����ɫ������� | ��ˮ�к�HClO |
C | ���ɫֽ���ϵμ���ˮ | ��ɫֽ����ɫ | ��ˮ����Ư���� |
D | ��FeCl2��Һ�еμ���ˮ | ��Һ����ػ�ɫ | ��ˮ���������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ��ʵ�������ʵ��ģ�ҵ������
��.����ʯ�Һ��Ȼ�粒����Ʊ�NH3

��1��NH3�ķ���װ��Ӧѡ��ͼ�е�__������ĸ���ţ����Ʊ�NH3�Ļ�ѧ����ʽΪ__��
��2�����ռ�һƿ�����NH3��ѡ��ͼ�е�װ�ã�������˳��Ϊ������װ����__��������������Сд��ĸ��ʾ����
��.�������ͼ��ʾ��ʵ��װ��ģ�ҵ�����Ʊ��������ᡣ

��3��ʵ��ʱ���þƾ����Ԥ�ȴ�����Ȼ��ͨ�뷴Ӧ���壬���������Ⱥ���ƾ���ƣ�����ʼ�ձ��ֺ��ȣ��¶ȿɴﵽ700�����ϣ��ɴ˿�֪�÷�Ӧ��__��������������������������Ӧ����Ӧ�Ļ�ѧ����ʽ��__��
��4��B���Լ�Ϊ__��NaOH��Һ��������__��
��5�����ư����������ı������Ʊ�����Ĺؼ���
�ٵ�����������ʱ��A�в����к���ɫ��������������а��̡����̵Ļ�ѧʽ��__��
����ʹ������������ȫת��Ϊ���ᣬ������n(NH3)��n(NO)����ѱ���Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.ȼ���Ⱥ��к��ȵ���ֵ�����淴Ӧ���������ͬ���ı䣬��1molS��s����2molS��s����ȼ���Ȳ����
B.��֪��2C��s��+2O2��g��=2CO2��g�� ��H=akJ/mol��2C��s��+O2��g��=2CO��g����H=bkJ/mol����a��b
C.H2��g����ȼ����Ϊ285.8kJ/mol�����ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��l����H=-571.6kJ/mol
D.��ӦNH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ��H=+185.57kJ/mol���ڵ��������²����Է����У����ڸ������������Է�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com