
【题目】甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
实验步骤 | 实验现象 | 实验结论及离子反应方程式 |
| 甲:___ 乙:___ | 离子反应方程式 甲:___ 乙:___ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
评价:甲同学设计的实验方案的合理性是___(填序号)
A.非常合理 B.完全不合理 C.部分合理
补充和完善:上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:___。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
(金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是___。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向___,写出电极反应式。电极反应式:____、____。
装置图
【答案】溶液由无色变为黄色 溶液由无色变为橙色 2Br-+Cl2=Br2+2Cl- 2I-+Cl2=2Cl-+I2 C Br2+2I-=I2+2Br- 锌粉的表面积大,也能加快反应速率  负极:Fe-2e-=Fe2+ 正极:2H++2e-=H2↑
负极:Fe-2e-=Fe2+ 正极:2H++2e-=H2↑
【解析】
(1)甲试管中加入氯水,溶液中溴离子被氯气氧化成溴单质,溶液由无色变为橙色,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,乙试管中加入氯水,溶液中的碘离子被氯气氧化成碘单质,溶液由无色变为黄色,反应的离子方程式为:2I-+Cl2=2Cl-+I2,由于乙试管使用的是氯水,无法证明溴单质的氧化性大于碘单质的氧化性,所以甲同学设计的实验方案部分合理,试管乙应该使用溴水,发生的离子方程式为Br2+2I-=I2+2Br-;
(2)两支试管中盐酸的浓度和锌的表面积不同,盐酸的浓度和锌的表面积都影响化学反应速率,所以无法证明浓度对反应速率的影响,正确方法应该将锌都改用同样的规格;
(3)用铁、铜作电极,稀硫酸作电解质溶液设计原电池,铁的金属性比铜强,所以铁作负极,铜作正极,电子从负极沿导线流向正极,原电池装置图为: ;发生的电极反应为:负极:Fe-2e-=Fe2+;正极:2H++2e-=H2↑。
;发生的电极反应为:负极:Fe-2e-=Fe2+;正极:2H++2e-=H2↑。


科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
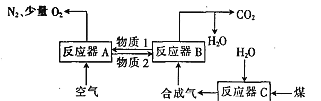
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
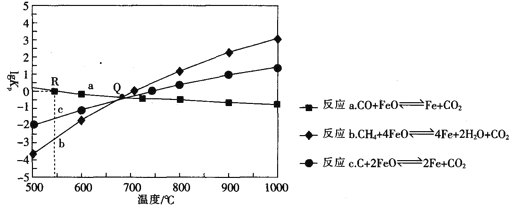
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是

A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .以下是实验室常用的部分仪器,请回答下列问题:
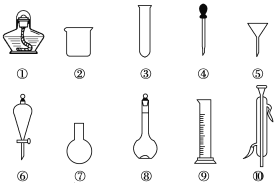
(1)序号为⑧和⑩的仪器的名称分别为______、______。
(2)在分液操作中,必须用到上述仪器中的____(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的___(填名称)。
(4)在配制溶液时,需要用到的仪器是________(填序号)。
(5)仪器上标有温度的是____(填序号)。
‖.请选择下列实验方法分离混合物,并将分离方法的序号填在横线上。
A 萃取分液; B 升华; C 结晶 ;D 分液 ;E 蒸馏 ; F 过滤。
(1)___分离饱和食盐水与沙子的混合物。
(2)___从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)____分离水和汽油的混合物。
(4)___分离CCl4和苯(二者互溶)的混合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用化学符号回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___。
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是___,最高价氧化物的水化物中酸性最强的是___。
(3)第三周期元素形成的简单离子中半径最小的微粒是___,写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式___、___。
(4)元素③的氢化物的电子式是___;该氢化物与元素⑩的氢化物发生反应的化学方程式___。
(5)用电子式分别写出元素⑨与元素②、⑥形成化合物过程___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A.可用氯气进行自来水的杀菌消毒Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B.FeCl2溶液中滴加氨水:Fe2++2OH-=Fe(OH)2↓
C.用稀硫酸清洗铁锈(氧化铁):Fe2O3+6H+=2Fe3++3H2O
D.用铜与稀硝酸反应制备一氧化氮:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.HCO3-水解:HCO3-+H2OCO32-+H3O+
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是

A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-![]() 2HSO3-的lgK=5.3
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com