
【题目】下列离子方程式不正确的是( )
A.可用氯气进行自来水的杀菌消毒Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B.FeCl2溶液中滴加氨水:Fe2++2OH-=Fe(OH)2↓
C.用稀硫酸清洗铁锈(氧化铁):Fe2O3+6H+=2Fe3++3H2O
D.用铜与稀硝酸反应制备一氧化氮:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】当不慎有大量Cl2扩散到周围空间时,处在环境中的人们可以用浸有一定浓度某种物 质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是
A.NaOHB.NaClC.NaHCO3D.NH3![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
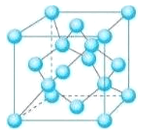
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
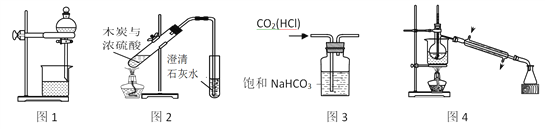
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
实验步骤 | 实验现象 | 实验结论及离子反应方程式 |
| 甲:___ 乙:___ | 离子反应方程式 甲:___ 乙:___ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
评价:甲同学设计的实验方案的合理性是___(填序号)
A.非常合理 B.完全不合理 C.部分合理
补充和完善:上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:___。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
(金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是___。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向___,写出电极反应式。电极反应式:____、____。
装置图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于气相反应,用某组分(B)的平衡压强[p(B)]代替物质的量浓度(cB)也可表示平衡常数(记作Kp)。已知反应CH4(g)+2H2O(g)CO2(g)+4H2(g),在t℃时的平衡常数 Kp=a,则下列说法正确的是
A.Kp=![]()
B.升高温度,若Kp 增大,则该反应为吸热反应
C.该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小
D.t℃时,反应![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)![]() CO2(g)+2H2 (g)的平衡常数Kp=
CO2(g)+2H2 (g)的平衡常数Kp=![]() a
a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下的同分异构体数目(不包括立体异构)正确的是
A. 结构简式为![]() 的一溴代物有4种
的一溴代物有4种
B. 分子组成是C4H8O2属于酯的同分异构体有6种
C. 分子式为C4H8属于烯烃的同分异构体有4种
D. C5H12O属于醇的同分异构体有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g),常压下该反应在1900℃的高温下才能进行,说明该反应的ΔH<0
B.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
C.将MgCl2·6H2O在坩埚中加热可获得MgCl2
D.反应2H2(g)+O2(g)![]() 2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 增大
增大
B.在0.1mol/LCH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+)
C.在10mL0.1mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)<Ksp(AgCl)
D.常温下,10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com