
【题目】下列叙述正确的是( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 增大
增大
B.在0.1mol/LCH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+)
C.在10mL0.1mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)<Ksp(AgCl)
D.常温下,10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
【答案】D
【解析】
A.AgCl、AgBr的饱和溶液中 ,温度不变溶度积不变,所以加入少量AgNO3,溶液中
,温度不变溶度积不变,所以加入少量AgNO3,溶液中![]() 不变,故A错误;
不变,故A错误;
B.根据电荷守恒n(OH-)+n(CH3COO-)=n(H+)+n(Na+),根据物料守恒得n(Na+)=n(CH3COO-)+n(CH3COOH),则存在n(OH-)=n(CH3COOH)+n(H+),因为溶液体积未知,无法计算钠离子物质的量,故B错误;
C.10mL0.1mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,生成AgCl沉淀,但AgNO3溶液过量,再加入6mL等浓度的Na2S溶液,为沉淀的生成,不能确定是否发生沉淀的转化,故C错误;
D.10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,碱过量,溶液应显碱性,混合溶液中c(OH-)=![]() =0.01mol/L,则溶液中c(H+)=10-12mol/L,溶液pH=12,故D正确;
=0.01mol/L,则溶液中c(H+)=10-12mol/L,溶液pH=12,故D正确;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A.可用氯气进行自来水的杀菌消毒Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B.FeCl2溶液中滴加氨水:Fe2++2OH-=Fe(OH)2↓
C.用稀硫酸清洗铁锈(氧化铁):Fe2O3+6H+=2Fe3++3H2O
D.用铜与稀硝酸反应制备一氧化氮:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
(1)以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如图所示。
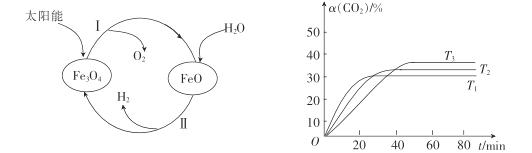
已知:H2O(l)= H2(g)+![]() O2(g)△H1+285.5kJ·mol-1
O2(g)△H1+285.5kJ·mol-1
过程I:2 Fe3O4(s)6 FeO (s)+O2(g)△H2=+313.2kJmol-1
则过程II的热化学方程式为 ______________________________。
(2)磁铁矿(Fe3O4)是工业上冶炼铁的原料之一,发生的主要反应为Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)△H <0,T℃ 时,在 1L 恒容密闭容器中加入Fe3O4、CO各0.5mol,5min反应达到平衡时,固体质量减小了6.4g。
①从起始到反应达到平衡时v(CO2)=______,T℃时,该反应的平衡常数K=________。
②欲提高该反应中 CO的平衡转化率,可采取的措施是______(任写一个即可)。
③其他条件不变时,该反应在不同温度下,CO2的产率随时间的变化α(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是____,判断依据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )

A.气态氢化物的稳定性:R>W
B.X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C.Y和Z两者最高价氧化物对应的水化物能相互反应
D.由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是

A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-![]() 2HSO3-的lgK=5.3
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
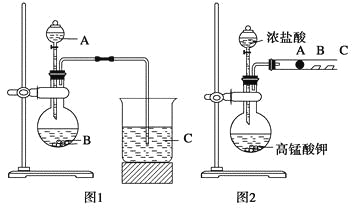
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
上述反应的离子方程式分别为______________________________________________;
________________________________________________________________________。
(2)乙同学的实验原理是________________________________________________。
写出B处的离子方程式: _________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
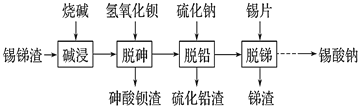
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
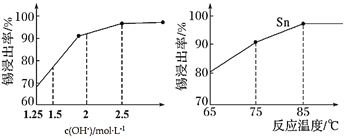
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。
(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3 ,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7 ·2H2O),其主要工艺流程如下图:

查阅资料得知:
i.常温下,NaBiO3 不溶于水,有强氧化性,在碱性条件下,能将 Cr 3+ 转化为CrO42- 。
ii.

回答下列问题:
(1)步骤③加的试剂为氢氧化钠溶液,此时溶液 pH 要调到5的目的是_________ 。
(2)写出④反应的离子反应方程式:________________
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是____________ (填操作名称)。
(4)取一定质量的固体 D 溶解于 200mL 的硫酸中,向所得溶液中加入5mol/L 的NaOH 溶液,生成沉淀的物质的量n与加入NaOH 溶液的体积V 关系如图所示,则硫酸的浓度为_______ ,固体 D 中含铁化合物的物质的量为__________ 。

Ⅱ.经检测该化工厂的工业废水中含 5.00×10 -3 mol·L -1 的 Cr2O72- ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4 (Fe 的化合价依次为+3、+2),又设计了如下工艺流程:

(1)第①步反应的离子方程式_______________ 。
(2)欲使 1L 该废水中的 Cr2O72- 完全转化为 Cr 0.5 Fe 1.5 FeO4 。理论上需要加FeSO4 ·7H2O 的质量为 ________g (已知 FeSO 4 ·7H2O 的摩尔质量为 278g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论一定错误的是
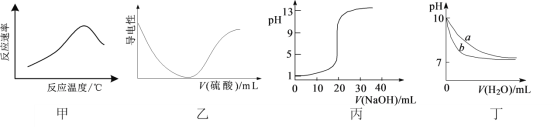
A.图甲表示酶催化反应的反应速率随反应温度的变化
B.图乙表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C.图丙表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
D.图丁表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com