
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
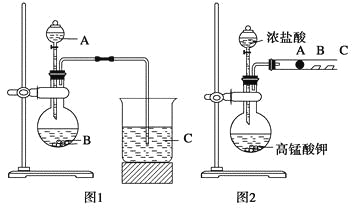
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
上述反应的离子方程式分别为______________________________________________;
________________________________________________________________________。
(2)乙同学的实验原理是________________________________________________。
写出B处的离子方程式: _________________________________________________。
【答案】强酸制弱酸 稀硝酸 碳酸钙 硅酸钠溶液 CaCO3+2H+=Ca2++2CO2↑+H2O SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- 强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质 2I-+Cl2=2Cl-+I2
【解析】
非金属性的强弱可以根据最高价氧化物的水化物的酸性强弱判断,而酸性的强弱可以根据强酸制弱酸判断。非金属性的强弱也可以用单质的氧化性强弱判断,非金属单质的氧化性可以通过非金属单质间的置换反应判断。
(1)要想证明酸性强弱,能利用强酸制弱酸的依据。三种元素对应的酸为硝酸,碳酸,硅酸,所以应用稀硝酸和碳酸钙反应生成碳酸,即二氧化碳,二氧化碳和硅酸盐反应生成硅酸。反应的离子方程式为:CaCO3+2H+=Ca2++2CO2↑+H2O, SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-。
(2)卤素单质的性质的氧化性依次减弱,利用强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质。用氯气和溴化钠反应生成氯化钠和溴,氯气和碘化钾反应生成氯化钾和碘,反应的离子方程式为:2I-+Cl2=2Cl-+I2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于气相反应,用某组分(B)的平衡压强[p(B)]代替物质的量浓度(cB)也可表示平衡常数(记作Kp)。已知反应CH4(g)+2H2O(g)CO2(g)+4H2(g),在t℃时的平衡常数 Kp=a,则下列说法正确的是
A.Kp=![]()
B.升高温度,若Kp 增大,则该反应为吸热反应
C.该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小
D.t℃时,反应![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)![]() CO2(g)+2H2 (g)的平衡常数Kp=
CO2(g)+2H2 (g)的平衡常数Kp=![]() a
a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
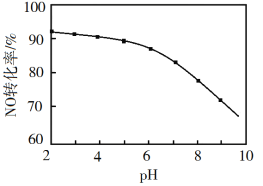
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。经2min该反应达到平衡状态,生成0.8molD,测得C的浓度为0.8mol/L。则下列判断错误的是
A.x=4
B.2min内B的反应速率为0.1mol·L-1·min-1
C.B的转化率为40%
D.该温度下平衡常数的值为1.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 增大
增大
B.在0.1mol/LCH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+)
C.在10mL0.1mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)<Ksp(AgCl)
D.常温下,10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是
A.2CH3COOH+Na2CO3![]() 2CH3COONa+H2O+CO2↑
2CH3COONa+H2O+CO2↑
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3-CH=CH2+Br2![]() CH3-CHBr-CH2Br
CH3-CHBr-CH2Br
D.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol/L NaOH溶液滴定 20.00mL0.1000mol/L某一元酸HA溶液,滴定曲线如图。下列说法正确的是
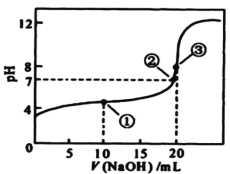
A.该滴定过程既能用甲基橙又能用酚酞作指示剂
B.点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C.点②所示溶液中:c(Na+) =c(HA) +c(A-)
D.水的电离程度随着NaOH溶液的滴入不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、W、X、Y、Z的原子序数依次增大,R的简单氢化物可用作制冷剂,X是短周期中金属性最强的元素。Y的简单离子在同周期元素的简单离子中半径最小,由W、X和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀(Z的单质)析出,同时产生有刺激性气味的气体(Z的氧化物)。下列说法正确的是( )
A. 原子半径:Z>Y>X>W
B. Z的简单氢化物的热稳定性比W的强
C. Y的氧化物既可溶于R的最高价氧化物对应的水化物水溶液,也可溶于R的氢化物水溶液
D. X与W、Z形成的化合物不少于三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流表的指针发生了偏转。请根据如图所示,回答下列问题:
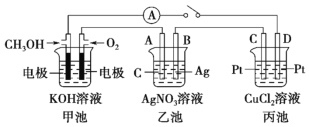
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____。
(2)乙池中 A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应化学方程式为__________。
(3)当乙池中 B 极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池中_____(填“C”或“D”)极析出_____g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,开关闭合一段时间后,甲中溶液的 pH将_____(填“增大”“减小”或“不变”,下同),丙中溶液的 pH 将______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com