
【题目】核安全与放射性污染防治已引起世界核大国的广泛重视。在爆炸的核电站周围含有放射性物质碘一131和铯一 137。碘—131—旦被人体吸入,可能会引发甲状腺等疾病。
(l)Cs(铯)的价电子的电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 | X | Y | Z |
第一电离能(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为_________,基态Z原子的核外电子排布式为______,X形成的单质晶体中含有的化学键类型是_________________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为______、______,BeF2分子的立体构型是____________,H2O分子的立体构型是________________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BC13分子中B—C1键的键角为__________________。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有____个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻______个I-。

(5)KI晶体的密度为ρg cm 3,K和I的摩尔质量分别为MK g mol-1和M1g mol-1,原子半径分别为rKpm和r1 pm,阿伏加德罗常数值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为_____________。
【答案】 Li、Na、K ls22s22p63s23p64sl 金属键 sp sp3 直线形 V形 120° 4 6 ![]() ×100%
×100%
【解析】(1)由铯的最外层电子排布式为6s1,可知A、B、C为第ⅠA族,ⅠA族前四周期的元素分别为H、Li、Na、K,由电离能表可知,A、B的第一电离能的差值与B、C的第一电离能的差值相差不大,所以A、B、C不可能有H元素,而同主族元素电子层数越多,第一电离能越小,故A、B、C分别为Li、Na、K;基态Z原子的核外电子排布式为:1S22S22P63S23P64S1;金属晶体,微粒间均以金属键结合。
(2)BeF2中,B的价层电子对数是2+![]() (2-2)=2,所以Be是sp杂化,空间构型为直线型;H2O中O的价层电子对数是2+
(2-2)=2,所以Be是sp杂化,空间构型为直线型;H2O中O的价层电子对数是2+![]() (6-2)=4,所以O是sp3杂化,空间构型为V型。
(6-2)=4,所以O是sp3杂化,空间构型为V型。
(3)硼原子价电子数为3,Cl提供3个电子,硼原子的价层电子对数为![]() =3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。
=3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。
(4)由碘晶胞结构图可知,碘分子位于晶胞的8个顶点和6个面上,故一个晶胞中含有4个I2分子;KI晶胞与NaCl晶胞结构相似,每个K+紧邻6个I-,同层的4个,上下各一个。
(5)由已知及上述分析,晶胞中原子所占的体积V1=(![]() πrK3×4+
πrK3×4+![]() πrI3×4)×10-30,晶胞的体积V2=
πrI3×4)×10-30,晶胞的体积V2=![]() =4×
=4×![]() ,故KI晶胞中原子的体积占晶胞体积的百分率为:
,故KI晶胞中原子的体积占晶胞体积的百分率为: ![]() ×100%,代入相应数据整理得,
×100%,代入相应数据整理得, 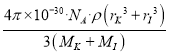 ×100%。
×100%。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
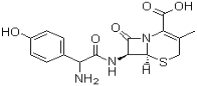
【题目】头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗。已知肽键可以在碱性条件下水解。下列对头孢羟氨苄的说法中正确的是
 ·H2O
·H2O
A.头孢羟氨苄的化学式为C16H16N3O5S·H2O
B.1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol
C.在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2
D.头孢羟氨苄能在空气中稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.严格执行机动车尾气排放标准有利于防止大气污染
B.使用二氧化硫增白的食品对人体健康产生损害
C.使用氯气对自来水消毒时生成的有机氯化物可能对人体有害
D.食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是2004年批量产生的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O2。下列说法正确的是( )

A. 左电极为电池的正极,a处通入的物质是甲醇
B. 右电极为电池的负极,b处通入的物质的空气
C. 负极反应式为:CH3OH+H2O-6e-═CO2↑+6H+
D. 正极反应式为:O2+2H2O+4e-═4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀产生的工业废水含有的重金属离子(Cu2+、Ni2+等)和CN形成难以除去的络合物,用电解法制备高铁酸钠(Na2FeO4)处理废水是目前比较先进的方法。已知氰化氢有毒易挥发。电解装置如图所示,下列选项正确的是( )
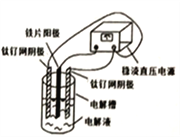
A. 铁片连接电源的负极
B. 电解时,每生成lmolFeO42-,转移电子3mol
C. CN被氧化成CO2和N2,Cu2+、Ni2+形成难溶碱而除去
D. 已知HFeO4-的氧化性比FeO42-更强,故pH<7时处理废水效率更高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:

可供选择的试剂:①饱和Na2CO3溶液;②饱和K2CO3溶液;③KOH溶液;④BaCl2溶液;⑤Ba(NO3)2溶液;⑥H2O2溶液;⑦KMnO4溶液(H+);⑧稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用______(填试剂编号),反应的离子方程式为____________。
(2)萃取操作中,可以选的试剂还可以是_________。
A. 裂化汽油 B.乙醇 C.苯 D.直馏汽油
(3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是__________。(填试剂序号)
(4)调节pH的作用是___________________________________。
(5)操作①的名称是_____,操作②中用到的硅酸盐仪器除酒精灯、玻璃棒外还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中化学元素和化合物的叙述,正确的是( )
A. 细胞中一种元素的作用能被其他元素替代
B. 细胞干重中含量最多的是氮元素
C. 细胞中含量最多的化合物是水
D. 细胞中的微量元素因含量极少而不如大量元素重要
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com