
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为________,Y的电子排布图为___________;
(2)ZX2的分子式是_________,分子构型为________。YX2的电子式是________,分子构型为_________,中心原子发生了_________杂化。
(3)Y与Z形成的化合物的分子式是____。Y的氢化物中分子构型为正四面体的是_________(填名称),键角为____,中心原子的杂化形式为_________。
(4)X的氢化物的分子构型为_________,键角为_________,中心原子的杂化形式_________。
【答案】1s22s22p4 ![]() SO2 V形
SO2 V形 ![]() 直线形 sp CS2 甲烷 109°28' sp3 V形 105° sp3
直线形 sp CS2 甲烷 109°28' sp3 V形 105° sp3
【解析】
化合物YX2、ZX2中X、Y、Z的核电荷数小于18,三元素处于短周期,Y原子的最外层中p能级的电子数等于前一能层电子总数,Y原子只能有2个能层,核外电子排布为1s22s2p2,故Y为碳元素;X原子最外能层的p能级中有一个轨道充填了2个电子,外围电子排布为ns2np4,处于ⅥA族,且X和Y具有相同的电子层数,故X为O元素;Z与X在周期表中位于同一主族,则Z为S元素。
(1)由上述分析可知,X为O元素,其电子排布式为1s22s2p4,Y为C元素,原子核外电子排布为1s22s2p2,故其轨道表示式为![]() ;
;
(2)由上述分析可知,ZX2的分子式是SO2,SO2的分子中价层电子对个数是2+![]() (6-2×2)=3,且含有一个孤电子对,所以其空间构型为V型,YX2为CO2,分子中C原子与O原子之间形成2对共用电子对,杂化方式为sp杂化,分子为直线型,其电子式是
(6-2×2)=3,且含有一个孤电子对,所以其空间构型为V型,YX2为CO2,分子中C原子与O原子之间形成2对共用电子对,杂化方式为sp杂化,分子为直线型,其电子式是![]() ;
;
(3)C与S形成的化合物是CS2,Y的氢化物中分子构型为正四面体的是甲烷,甲烷分子中碳原子含有4个共价单键,且不含孤电子对,所以碳原子为sp3杂化,所以分子为正四面体型,键角为109°28′;
(4)O的最简单氢化物是水,水分子是V形结构,水分子中中键角为105°,水分子中O原子含有2个共价单键,有两对孤电子对,所以O原子为sp3杂化。


科目:高中化学 来源: 题型:
【题目】分析下列有机化合物的结构简式,完成填空。
①CH3CH2CH2CH2CH3②C2H5OH③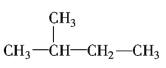 ④
④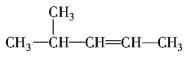 ⑤
⑤![]() ⑥
⑥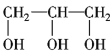 ⑦
⑦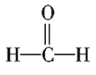 ⑧
⑧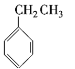 ⑨
⑨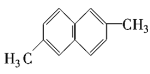 ⑩
⑩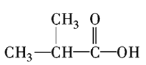
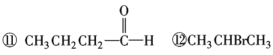
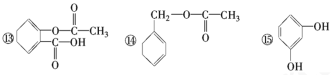
请你对以上有机化合物进行分类,其中,
属于烷烃的是________;属于烯烃的是________;
属于芳香烃的是________;属于卤代烃的是________;
属于醇的是________;属于醛的是________;
属于羧酸的是________;属于酯的是________;
属于酚的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。某兴趣小组同学用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验,步骤如下:
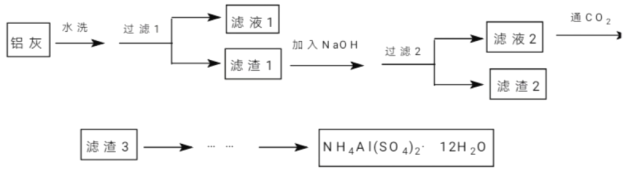
(1)下列有关说法中正确的是_________。
A.“滤液1”中含有K+、Mg2+、Cl-
B.“滤渣1”和“滤渣2”中含有相同的物质
C.“过滤1”可用倾析法,以缩减实验时间
D.将“滤液3”蒸干并灼烧,可得纯碱
(2)用NaOH溶解“滤渣1”时,可以采用_________的方式提高浸出率(写出3条)。
(3)向“滤液2”中通入足量的CO2,写出相应的离子反应方程式__________________。
(4)由“滤渣3”制备铵明矾,经过如下步骤:a→g→_________→h(依次填入正确的序号)
a.加硫酸溶解 b.抽滤
c.加入蒸发皿中
d.降温结晶
e.蒸发至表面出现晶膜
f.配制饱和硫酸铵溶液
g.将硫酸铝溶液转移至蒸发皿
h.洗涤、干燥
(5)①根据各物质的溶解度曲线(见下图),在80℃时,用一定浓度的硫酸溶解“滤渣3”时,最适宜的硫酸浓度为_________。

A.3mol/L(1.20g/mL)
B.6mol/L(1.34g/mL)
C.9mol/L(1.49 g/mL)
D.18mol/L (1.84g/mL)
②所需硫酸用量的简便确定方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据中国之声《全国新闻联播》报道,中科院今天(2019年1月13日)通报,我国纳米技术已在动力锂电池、绿色印刷、纳米催化、健康诊疗及饮用水处理等产业领域取得重要成果。我国储氢纳米碳管研究亦获重大进展,用电弧法合成储氢纳米碳管,其原理是阳极石墨电极在电弧产生的高温下蒸发,在阴极沉积出纳米管。

此法常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化法提纯。其反应式为3C+2K2Cr2O7+8H2SO4![]() 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)纳米材料分散到溶剂中形成的分散系是________。
(2) K2Cr2O7中Cr的化合价为________。反应中氧化剂为________,发生________反应,还原剂是________,具有________性。
(3)该反应转移的电子数为________。
(4)若反应过程中转移4.816×1023个电子,则生成标准状况下________L CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
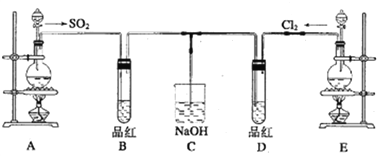
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弾的工作电源。一种热激活电池的基本结钩如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb,下列有关说法正确的是( )

A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 每转0.2mol电子,论上消耗42.5gLiCl
D. 电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是
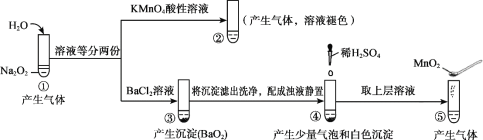
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①9.8g H2SO4的物质的量为______mol,约含有________个H2SO4 分子
②标准状况下,22.4LH2的质量为__________ g
③将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后NaCl溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.烷烃![]() 的同分异构体只有2种
的同分异构体只有2种
B.淀粉、纤维素和蛋白质在酸催化下完全水解后的产物都是葡萄糖
C.![]() 、HCOOH和
、HCOOH和![]() 都能与银氨溶液发生银镜反应
都能与银氨溶液发生银镜反应
D.煤的气化、液化和干馏发生的是物理变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com