
【题目】已知某些元素在周期表中的位置如图所示:
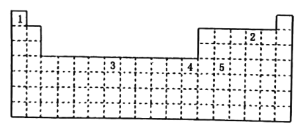
下列说法正确的是( )
A.表中五种元素位于5个不同的区
B.元素4的基态原子的价电子排布式为3d104s2与它具有相同最外层电子数的元素只可能处于ds区
C.元素1、2、3的基态原子中,未成对电子数之比为1:3:5
D.元素5的原子结构示意图为:
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图所示),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
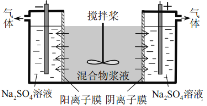
用惰性电极电解时,CrO42-能从浆液中分离出来的原因是_________________________,分离后含铬元素的粒子是__________,阴极室生成的物质为__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取FeCO3的工艺流程如下:
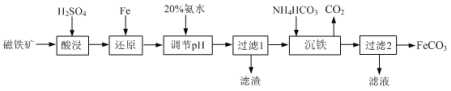
(1)“酸浸”时Fe3O4发生反应的离子反应方程式为 _______ 。
(2)“酸浸”过程中加入过量硫酸的目的是 _______ 和 _______ 。
(3)当溶液中金属离子浓度小于10-5mol·L-1时,则认为金属离子沉淀完全。若还原反应后溶液中c(Fe2+)=0.1 mol·L-1,则常温下加入20%氨水应调pH的范围为 _______ 。{已知:Ksp[Fe(OH)2]=1×10-17,Ksp[Al(OH)3]=1×10-32}
(4)“过滤1”所得滤渣除Fe、Al(OH)3外还有 _______ 。
(5)“沉铁”反应的离子方程式为: _______ 。
(6)若将“沉淀”试剂NH4HCO3改成Na2CO3,则溶液的混合方式为 _______ (填字母)。
A 向“过滤1”的滤液中滴加Na2CO3溶液,并充分搅拌
B 向Na2CO3溶液中滴加“过滤1”的滤液,并充分搅拌
C “过滤1”的滤液和Na2CO3溶液同时加入,并充分搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示。下列溶液中离子浓度关系正确的是
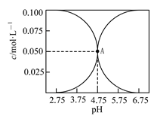
A.c(Na+)=0.1 mol·L-1的溶液中: c(H+)+c(CH3COOH)=c(OH-)
B.点A溶液中:c(Na+)>c(CH3COOH)
C.pH=3.5的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.c(CH3COO-)=0.025 mol·L-1的溶液中:3c(Na+)<c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取纯净![]() 固体用如下方法制备
固体用如下方法制备![]() 。
。
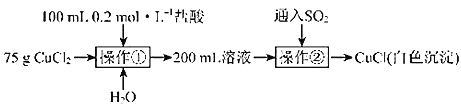
(4)操作②中反应的离子方程式为_________。
(5)操作①中若用![]() 盐酸代替
盐酸代替![]() 盐酸,再通入
盐酸,再通入![]() 后,无白色沉淀产生。对此现象有如下两种猜想:
后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:![]() 过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、
过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、![]() 盐酸及________
盐酸及________![]() 配制
配制![]() 溶液,再进行操作②,观察是否有白色沉淀产生。
溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:____________。为验证此猜想,取少量白色沉淀加入饱和氯化钠溶液中,搅拌,观察白色沉淀是否溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
A.在此温度下液氨的离子积为1×10-17
B.在液氨中放入金属钠,可生成NaNH2
C.恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D.降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 AG 表示溶液酸度:AG=lg![]() 。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
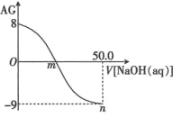
A.常温下 CH3COOH 的 Ka 数量级为 10-6
B.m 点加入 NaOH 的体积为 25 mL
C.n 点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在滴加 NaOH 溶液的过程中,溶液中 m 点水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com