
【题目】一种有机物的结构简式为:
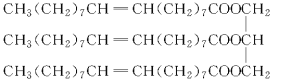
试回答下列问题:
(1)该化合物的种类是________。
A.烯烃 B.酯
C.油脂 D.高分子化合物
(2)该化合物的密度________。
A.比水大 B.比水小
(3)该化合物常温下的状态为________。
A.液体 B.固体 C.气体
(4)与该物质能反应的有________。
A.NaOH溶液
B.碘水
C.乙醇
D.乙酸
E.H2
写出该有机物与选出的化合物反应的化学方程式(任写一个):________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ?mol﹣1
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H=+2b kJ?mol﹣1
O2(g)═2CO2(g)+H2O(l)△H=+2b kJ?mol﹣1
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ?mol﹣1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJmol﹣1 , 甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式;已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=kJmol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是(选填编号,注意大小写).
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将(填“变大”、“变小”或“不变”,下同).
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣ , 请写出该反应的负极反应式;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH﹣)=mol/L(假设溶液的体积不变,气体全部从溶液中逸出). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5molL﹣1 盐酸、0.55molL﹣1NaOH溶液,尚缺少的实验玻璃用品是、 .
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”).
(3)他们记录的实验数据如下:已知:Q=Cm(t2﹣t1),反应后溶液的比热容C为4.18kJ℃﹣1kg﹣1 , 各物质的密度均为1gcm﹣3 . ①计算完成下表.(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 中和热△H | ||
t1 | t2 | ||||
① | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将(填“变大”或“变小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图,

进行皂化反应时的步骤如下:
(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是____________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为________。
(4)图中长玻璃导管的作用为__________________________________。
(5)写出该反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y. ①甲同学认为X中除Fe3+外还可能含有Fe2+ . 写出生成Fe2+所有可能的离子方程式: .
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: .
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为 .
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g.计算放出H2的体积为升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120ml 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120ml)mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
B. Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
C. NaCl与Na2CO3灼烧时火焰颜色不相同
D. Na2O2可作供氧剂,而Na2O不行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出由甲苯制备TNT的化学反应方程式;
(2)写出溴水与苯酚反应的化学反应方程式 .
(3)如图是8种环状的烃类物质: 
①互为同系物的有和(填名称,下同);互为同分异构体的有和、和:
②棱晶烷的二氯取代产物有种;
③有机物X、Y均与立方烷具有相同的摩尔质量,其中X属于芳香烃,且能使溴水褪色;Y是烃的含氧衍生物,分子中含有3个氧原子,可水解生成3种含碳的化合物,则X的结构简式为:;Y的结构简式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com