
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJmol﹣1 , 甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式;已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=kJmol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是(选填编号,注意大小写).
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将(填“变大”、“变小”或“不变”,下同).
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣ , 请写出该反应的负极反应式;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH﹣)=mol/L(假设溶液的体积不变,气体全部从溶液中逸出). 
【答案】
(1)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;﹣378.8
(2)ad;变小
(3)CH3OCH3+16OH﹣﹣12e﹣=2CO32﹣+11H2O
(4)Y电极附近溶液中有气体产生,上部分呈黄绿色;1
【解析】解:(1)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;
H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1 , 热化学方程式为
①H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8KJ/mol;
O2(g)=H2O(l)△H=﹣285.8KJ/mol;
②C(s)+O2(g)=CO2(g)△H=﹣393.5KJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;
依据盖斯定律计算①×3+②×2﹣③得到反应热化学方程式为:2C(s)+3H2(g)+ ![]() O2(g)═CH2OCH3(g)△H=﹣169.4kJ/mol;即可得到4C(s)+6H2(g)+O2(g)═2CH2OCH3(g)△H=﹣378.8kJ/mol;
O2(g)═CH2OCH3(g)△H=﹣169.4kJ/mol;即可得到4C(s)+6H2(g)+O2(g)═2CH2OCH3(g)△H=﹣378.8kJ/mol;
所以答案是:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;﹣378.8kJ/mol;(2)①a、在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,反应达平衡,故A选;
b、单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志,故B不选;
c、本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ= ![]() 一直不变,故密度不变不能作为平衡的标志,故c不选;
一直不变,故密度不变不能作为平衡的标志,故c不选;
d、此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,故d选.
所以答案是:ad;②反应为放热反应,故升高温度,平衡左移,达到新的平衡,CH3OCH3的产率将变小;
所以答案是:变小;(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH﹣﹣12e﹣=2CO32﹣+11H2O;
所以答案是:CH3OCH3+16OH﹣12e﹣=2CO2﹣3+11H2O;(4)电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;
当燃料电池消耗2.8LO2(标准状况下)物质的量= ![]() =0.125mol,电极反应为O2+2H2O+4e﹣=4OH﹣ , 电子转移为0.5mol,阴极电极方程式:2H2O+2e﹣=2 OH﹣+H2 , 所以n(OH﹣)=0.5 mol,c(OH﹣)=
=0.125mol,电极反应为O2+2H2O+4e﹣=4OH﹣ , 电子转移为0.5mol,阴极电极方程式:2H2O+2e﹣=2 OH﹣+H2 , 所以n(OH﹣)=0.5 mol,c(OH﹣)= ![]() =1 mol/L;
=1 mol/L;
所以答案是:Y电极附近溶液中有气体产生,上部分呈黄绿色;1.
【考点精析】通过灵活运用化学平衡状态的判断,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等即可以解答此题.


科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物:A+B ![]() C
C ![]()
![]() A+B.能实现上述转化关系的是( ) ①若C溶于水后得到强碱溶液,则A可能是Na
A+B.能实现上述转化关系的是( ) ①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3 , 放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu.
A.①②
B.②④
C.①③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小20%.下列说法正确的是( )
A.该温度下此反应的平衡常数K=400
B.其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,SO2的体积分数增大
C.平衡时,SO2的转化率为95%
D.前2min SO2的平均反应速率0.02mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( ) 
A.该反应可表示为:2A(g)+B(g)C(g)△H<0
B.t℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A.过滤时,玻璃棒的末端应轻轻靠在三层滤纸上
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.称氢氧化钠时,不能直接称量,要放在纸片上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生. 
(1)S为(填“正”或“负”)极.
(2)A极附近溶液的现象是 , B 极附近发生的电极反应式为 .
(3)滤纸上的紫色点向(填“A”或“B”)方移动.
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为(填“正”或“负”)极,电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机物的结构简式为:
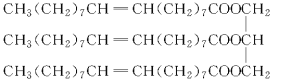
试回答下列问题:
(1)该化合物的种类是________。
A.烯烃 B.酯
C.油脂 D.高分子化合物
(2)该化合物的密度________。
A.比水大 B.比水小
(3)该化合物常温下的状态为________。
A.液体 B.固体 C.气体
(4)与该物质能反应的有________。
A.NaOH溶液
B.碘水
C.乙醇
D.乙酸
E.H2
写出该有机物与选出的化合物反应的化学方程式(任写一个):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的分子式为C4HxCly , 其中x+y=10,已知该有机物有9种同分异构体(不考虑立体异构),则X可能为:①2,②3,③8,④10.下列组合正确的是( )
A.①③
B.①②
C.②③
D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com