
【题目】工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(含单质碳)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应先用(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:Br2+SO2+2H2O═H2SO4+2HBr,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2(标准状况下)的体积为 .
(3)[探究二]
分析上述实验中SO2体积的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).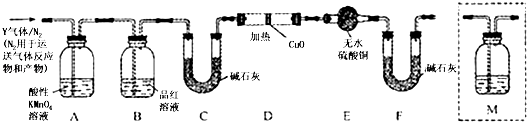
装置B中试剂的作用是 .
(4)认为气体Y中还含有CO2的理由是(用化学方程式表示).
(5)为确认CO2的存在,需将M(装有澄清石灰)添加于 (选填序号).
a.A之前 b.A~B间 c.B~C间 d.C~D间
(6)如果气体Y中含有H2 , 预计实验现象应是 .
【答案】
(1)铁钉表面被钝化
(2)d;224mL
(3)检验二氧化硫是否除尽
(4)C+2H2SO4(浓硫酸) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)c
(6)D中固体由黑变红和E中固体由白变蓝
【解析】解:(1)铁钉放入冷硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,发生钝化现象,故答案为:铁钉表面被钝化;(2)①亚铁离子能使酸性高锰酸钾褪色,溶液中已经有三价铁离子,选择a会造成干扰,b能检验三价铁离子的存在,选c生成两种沉淀,受氢氧化铁沉淀颜色的影响无法分辨,故选d,
故答案为:d;②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4 , 生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)= ![]() =0.015mol;
=0.015mol;
SO2 | ~ | BaSO4 |
1mol | 233g | |
n | 2.33g |
n=0.01mol
所以二氧化硫的体积为:0.01mol×22.4L/mol=0.224L=224mL,故答案为:224mL;(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫,故答案为:检验二氧化硫是否除尽;(4)在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应方程式为
C+2H2SO4(浓硫酸) ![]() CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓硫酸)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓硫酸) ![]() CO2↑+2SO2↑+2H2O;(5)Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,故选C;(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成,故答案为:D中固体由黑色变红和E中固体由白变蓝.
CO2↑+2SO2↑+2H2O;(5)Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,故选C;(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成,故答案为:D中固体由黑色变红和E中固体由白变蓝.
(1)常温条件下,铁与浓硫酸能产生钝化现象;(2)根据亚铁离子的性质选取试剂,亚铁离子有还原性,可用强氧化性的物质检验,且必须有明显的实验现象;(3)二氧化硫能使品红溶液褪色,从而检验二氧化硫是否存在;(4)根据铁钉的成分分析,铁钉中的铁和碳在加热条件下都能与浓硫酸发生氧化还原反应;(5)根据二氧化硫和二氧化碳的性质分析选择位置;(6)根据氢气的性质分析,氢气具有还原性,能还原黑色的氧化铜而生成水,水能使白色的无水硫酸铜变蓝.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】我国科技人员全球首创3290块长宽均为800毫米,重量仅为2.85公斤的可折叠光影屏助阵70周年国庆庆典。下列有关说法正确的是
A.光影屏中安装的计算机芯片,其材质是二氧化硅
B.为提升光影屏的续航能力,翻倍提高电池的能量密度
C.光影屏选用可折叠LED,其工作原理是将化学能转化为电能
D.为减轻光影屏的重量,选用的ABS工程塑料和碳纤维都是有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO3- ⑧NH4+分别加入H2O中,基本不影响水的电离平衡的是
A.①③⑤⑦⑧B.①⑥C.②④⑦D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式 S(s)+O2(g)=SO2(g) ΔH=-297.23 kJ·mol-1,说法正确的是
A.该反应是吸热反应
B.S 与 O2 反应的反应热是 297.23 kJ
C.1molSO2(g)的总能量小于 1molS(s)和 1molO2(g)能量总和
D.1molSO2(g)的总能量大于 1molS(s)和 1molO2(g)能量总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某种盐后铜粉逐渐溶解,这种盐是( )
A. NaCl B. KNO3 C. K2SO4 D. Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明某溶液只含有Fe2+而不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
D.只需滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与CO、H2O以物质的量1︰1︰1的比例形成B,B中的两个官能团分别具有乙烯和乙酸中官能团的性质,E是有芳香气味、不易溶于水的油状液体,有关物质的转化关系如下:
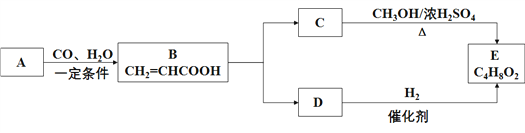
请回答:
(1)A的结构简式__________。
(2)D→E的反应类型__________。
(3)CE的化学方程式________________________________________。
(4)下列说法不正确的是__________。
A.可用金属钠鉴别B和C
B.A在一定条件下可与氯化氢发生加成反应
C.乙酸和乙醇在浓硫酸作用下加热也可生成E
D.与A的最简式相同,相对分子质量为78的烃一定不能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁及其化合物的说法正确的是( )
A. 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质
B. 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
C. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
D. 水溶液中Fe2+、H+、SO![]() 、ClO-不能大量共存
、ClO-不能大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com