
【题目】下列混合物能用分液法分离的是
A.乙醇与乙酸B.乙酸乙酯和Na2CO3溶液
C.苯和乙醇D.葡萄糖与果糖混合液
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】_________________________________(用离子方程式表示)
【实验内容及记录】

请回答:
(1)根据上表中的实验数据,可以得到的结论是_______________。
(2)利用实验1中数据计算,用H2C2O4的浓度变化表示的反应速率v(H2C2O4)=________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
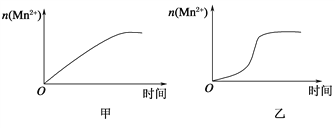
①该小组同学提出的假设是_______________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。__________

③若该小组同学提出的假设成立,应观察到的现象是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积一定的容器中,可逆反应A(s)+3B(g) ![]() 3C(g)达到平衡的标志是( )
3C(g)达到平衡的标志是( )
A. 容器内每减少1mol A,同时生成3mol C
B. 容器内的气体密度不再改变
C. 混合气体总的物质的量不变
D. 容器内每减少1mol A,同时消耗3mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(含单质碳)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应先用(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:Br2+SO2+2H2O═H2SO4+2HBr,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2(标准状况下)的体积为 .
(3)[探究二]
分析上述实验中SO2体积的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).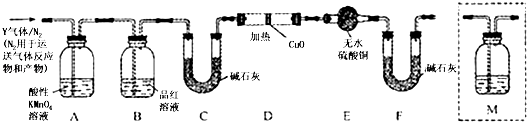
装置B中试剂的作用是 .
(4)认为气体Y中还含有CO2的理由是(用化学方程式表示).
(5)为确认CO2的存在,需将M(装有澄清石灰)添加于 (选填序号).
a.A之前 b.A~B间 c.B~C间 d.C~D间
(6)如果气体Y中含有H2 , 预计实验现象应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c (NO2) | c (NO) | c (O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B. 达平衡时,容器Ⅱ中c(O2)/ c(NO2)比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为T2时,若k正=k逆,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
催化剂能改变化学反应的速率,原因是改变化学反应的路径.某同学在实验中发现,向2mL5%H2O2溶液中分别滴入FeCl3和FeCl2溶液,都立即产生大量气泡;向反应后的溶液中滴入几滴KSCN溶液,溶液均变为红色.查阅资料知:FeCl3在H2O2分解中发生如下反应:
①2Fe3++H2O2═2Fe2++2H++O2↑ ②2Fe2++2H++H2O2═2Fe3++2H2O
(1)在反应①中Fe3+作;在反应②中Fe3+是 . 有同学认为Fe2+也可作H2O2分解的催化剂,你认为该观点是否正确,并简述理由
.
(2)反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,加入少许MnSO4固体能明显观察到溶液紫色褪去时间变短.在试管中加入4mL0.01mol/LKMnO4酸性溶液和2mL0.1mol/LH2C2O4溶液,实验初始阶段时间﹣速率图象合理的是图1中的(填序号). 
(3)某反应体系中存在A、B、C、D四种物质,反应过程中各物质的物质的量变化如图2所示,请写出该反应的化学方程式 .
(4)焙烧明矾产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)═2SO3(g)△H1=﹣197kJmol﹣1;
H2O(g)═H2O(l)△H2=﹣44kJmol﹣1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=﹣545kJmol﹣1 .
则SO3(g)与H2O(l)反应的热化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com