
����Ŀ����ѧ����Ƴ�����ĤH2Sȼ�ϵ�أ�ʵ��������H2S������Դ�����������õ�����������ĤH2Sȼ�ϵ�صĽṹʾ��ͼ����ͼ��ʾ������˵������ȷ����
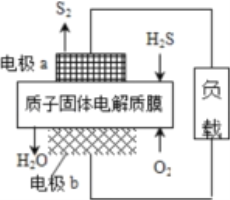
A. �缫aΪ��صĸ���
B. �缫b�Ϸ����ĵ缫��ӦΪ��O2 +4H+ + 4e��=== 2H2O
C. ��·��ÿ����4 mol���ӣ�����������44.8 LH2S
D. ÿ17 g H2S���뷴Ӧ����1 mol H+������Ĥ����������
���𰸡�C
��������A������ͼʾ���缫a��H2Sʧȥ���ӱ�������S2���缫aΪ������A����ȷ��B���缫b��O2�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪO2+4H++4e-=2H2O��B����ȷ��C��H2S�ڸ��������ģ������缫��ӦʽΪ2H2S-4e-=S2+4H+����·������4mol���ӣ���������2molH2S��H2S�����¶Ⱥ�ѹǿδ֪������������H2S�������C�����D��n��H2S��=![]() =0.5mol���������������缫��Ӧʽ��ÿ17gH2S���뷴Ӧ��1molH+������Ĥ������������D����ȷ����ѡC��
=0.5mol���������������缫��Ӧʽ��ÿ17gH2S���뷴Ӧ��1molH+������Ĥ������������D����ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5��ֱ��С�ڵ���2.5��m�����������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش���������
��1����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��/mol��L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������жϴ�������Ϊ__����ᡱ����ԣ���ʾ����������Ե�c(H+)��c(OH-)=___mol��L-1��
��2��úȼ���ŷŵ������к���SO2��NOx�����γ����꣬��Ⱦ����������NaClO2��Һ�ڼ��������¿ɶ�������������������Ч���dz��á�������ж������������̵����ӷ���ʽ��
��____��ClO2-+��____��NO+��____��OH-=��____��Cl-+��____��NO3-+______
��3��Ϊ����SO2�Ի�������Ⱦ������ú̿ת��Ϊ��������ȼ�ϣ������������д������������е�SO2��
��д����̿��ˮ������Ӧ�Ļ�ѧ����ʽ��__��
���������ʿ�����������������SO2����__������ĸ���ţ���
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
��4������β����NOx��CO�����ɼ�ת����
����������ʱ�����¶ȸߣ������л�����NO����ѧ����ʽΪ___��
������ȼ�Ͳ���ȫȼ��ʱ����CO��������β��ϵͳ��װ�ϴ�ת������ʹCO��NO��Ӧת��Ϊ����Ⱦ�����Ե��������壬�仯ѧ��Ӧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ӿ��徧���ṹ��ͼ��ʾ��xλ��������Ķ��㣬Yλ�����������ġ���
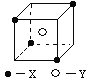
��1��������ÿ��Yͬʱ������___��X��ÿ��xͬʱ������__��Y���þ���Ļ�ѧʽΪ___��
��2����������ÿ��X��Χ������ӽ��Ҿ�����ȵ�X����___����
��3�������о��������2��X��1��Y�γɵļнǡ�XYX�Ķ���Ϊ__��
��4�����з����к���sp��sp3�ӻ���ʽ����___��
A.![]() B.CH4 C.CH2=CHCH3 D.CH3CH2C��CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C��CH E.CH3CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC(s)+H2O(g)![]() CO(g)+H2(g)��һ���ݻ����ܱ������н��У�������˵��������У��ܹ���������( )
CO(g)+H2(g)��һ���ݻ����ܱ������н��У�������˵��������У��ܹ���������( )
A. ��������������������������Сһ�룬��Ӧ���ʼ�С
B. ����������䣬��������He����ʹ��ϵѹǿ����Ӧ����һ������
C. ��Ӧ��ƽ��״̬ʱ��v(CO)��=v(H2O)��
D. �����������䣬�ʵ�����C(s)��������ʹ��Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������
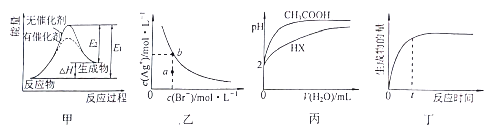
A. ͼ�ױ�ʾ���ȷ�Ӧ��������������·�Ӧ�����е������仯
B. ͼ�ұ�ʾһ���¶��£��廯����ˮ�еij����ܽ�ƽ�����ߣ�����a��������Dz�������Һ��b��������DZ�����Һ
C. ͼ����ʾ25��ʱ���ֱ��ˮϡ�������Ϊ100mL��pH=2��һԪ��CH3COOH��Һ��HX��Һ����25��ʱHX�ĵ���ƽ�ⳣ������CH3COOH
D. ͼ����ʾij���淴Ӧ����������淴Ӧʱ��仯����������ͼ֪tʱ��Ӧ��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.2mol��L-1H2C2O4��Һ�еμ�0.2mol��L-1NaOH��Һ���й��������ʵ����仯������ͼ��ʾ��[��֪CaC2O4������ˮ]������ͼʾ������˵������ȷ���ǣ� ��
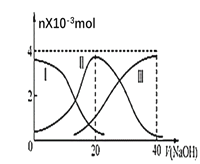
A.���ߢ������������HC2O4-
B.��V��NaOH��=20mLʱ����Һ������Ũ�ȵĴ�С��ϵΪ��c��Na+����c��HC2O4-����c��C2O42-����c��H+����c��OH-��
C.NaHC2O4��Һ��c��OH-��+c��C2O42-��=c��H+��+c��H2C2O4��
D.��NaHC2O4��Һ������CaCl2��ĩ����ֽ��裬��ҺpH������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����![]() ��
��![]() �Ļ����9.20g��100mL���ᷴӦ��
�Ļ����9.20g��100mL���ᷴӦ��
��1�������״��������![]() �����ʱ������Ҫʲô����_______��
�����ʱ������Ҫʲô����_______��
��2����![]() ��
��![]() ���ǵ����ʵ�����ϣ���9.20g������������ȫ��Ӧʱ���ڱ�״��������
���ǵ����ʵ�����ϣ���9.20g������������ȫ��Ӧʱ���ڱ�״��������![]() ������������Χ��V��Ϊ____��
������������Χ��V��Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
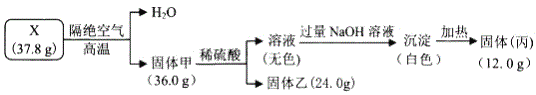
����Ŀ��Ϊ̽���������X������4�ֶ�����Ԫ�أ�����ɺ����ʣ����й����ҿ��������ά�����������ʵ�飺
��ش�
��1��X�Ļ�ѧʽΪ_____��
��2��X��������һ�ֽ���Ԫ����___��Ԫ�ط��ţ����䵥����![]() ��ȼ�յĻ�ѧ����ʽΪ_____��
��ȼ�յĻ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����ijһ��ѧԪ�ء�
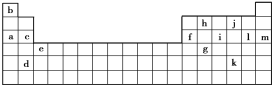
��1������________����д��ţ���Ԫ�صĵ��ʿ��ܶ��ǵ�������塣
��a��c��h ��b��g��k ��c��h��l ��d��e��f
��2������13��Ԫ���У�____����д��ĸ��Ԫ��ԭ��ʧȥ�����һ��������Ҫ��������ࡣi�����ڱ��е�λ��_________��
��3���������������㹻����������Щ���ӱ�����ԭ�Ӻ˵���������ȥ����������뿪��ԭ�ӻ���������Ҫ��������Ҫ���������ص�Ӱ�죺ԭ�Ӻ˶Ժ�����ӵ����������γ��ȶ��ṹ������
�±���һЩ��̬ԭ��ʧȥ���ⲻͬ���������������kJ��mol��1����
� | X | Y | |
ʧȥ��һ������ | 519 | 502 | 580 |
ʧȥ�ڶ������� | 7296 | 4570 | 1820 |
ʧȥ���������� | 11799 | 6920 | 2750 |
ʧȥ���ĸ����� | 9550 | 11600 |
��ͨ��������Ϣ�ͱ��е����ݷ���Ϊʲô�ԭ��ʧȥ����ڶ�������ʱ���������ҪԶԶ����ʧȥ��һ���������������______________��
�ڱ���X����Ϊ����13��Ԫ���е�_____����д��ĸ��Ԫ�ء���Ԫ�ط��ű�ʾX��j�γɻ�����Ļ�ѧʽ_____��
��Y�����ڱ���_____��Ԫ�ء�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com