
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
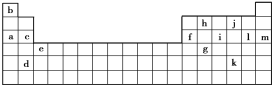
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)以上13种元素中,____(填写字母)元素原子失去核外第一个电子需要的能量最多。i在周期表中的位置_________。
(3)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向。
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1);
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量______________。
②表中X可能为以上13种元素中的_____(填写字母)元素。用元素符号表示X和j形成化合物的化学式_____。
③Y是周期表中_____族元素。
【答案】①④ m 第三周期ⅤA族 Li原子失去1个电子后形成稳定结构,此时再失去1个电子很困难 a Na2O和Na2O2 ⅢA
【解析】
(1)金属是导体(锗是半导体),石墨是导体;
(2)越容易失去第一个电子,第一电离能越小;
(3)根据电离能的大小结合原子核外电子排布判断可能的元素种类,注意电离能的大小能判断出元素的化合价,即最外层电子数。
根据元素周期表中元素的分布知识,可以知道a是Na,b是H,c是Mg,d是Sr,e是Sc,f是Al,g是Ge,h是C,j是O,i是P,k是Sb,l是Cl,m是Ar;
(1)金属是电的良导体,石墨棒是电的良导体,金属有Na、Mg、Sr、Sc、Al,锗是半导体,故答案为:①④;
(2)从题目所给信息知道,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关.结构越稳定失电子所需能量越高,在所给13种元素中,处于零族的m元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多;i是P,位于元素周期表的第三周期ⅤA族;
(3)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题给信息可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量;
②由表中数据可知:X失去第2个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需能量皆不足前者的两倍,故第一个电子为最外层的1个电子,而其他几个电子应处于内层;结合所给的周期表知,X应为a,即钠元素,和j即氧元素所形成的化合物化学式分别为Na2O和Na2O2;
③由表中所给Y的数据可知,Y失去第1、2、3个电子所需能量差别不大,而失去第4个电子所需能量远大于失去第3个电子所需的能量,因此Y元素的最外层有3个电子,即为ⅢA族的元素Al。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下图所示。下列说法不正确的是
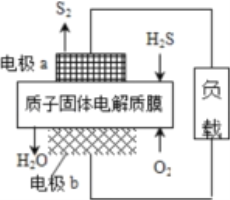
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2 +4H+ + 4e﹣=== 2H2O
C. 电路中每流过4 mol电子,在正极消耗44.8 LH2S
D. 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Cl2(g)![]() 2HCl(g)的反应能量变化示意图如下。下列说法不正确的是
2HCl(g)的反应能量变化示意图如下。下列说法不正确的是

A. 键的断裂过程是吸热过程,键的形成过程是放热过程
B. “假想的中间物质”的总能量高于起始态H2和Cl2的总能量
C. 反应的△H=[(a+b)-2c]kJ/mol
D. 点燃条件和光照条件下,反应的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示图像中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按题给信息将相应图的字母填入下列空格中,并写出所发生反应的离子方程式。
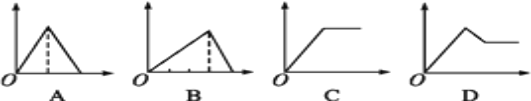
(1)表示向饱和AlCl3溶液中滴加氨水至过量的图像是_____(填字母,下同)
(2)表示向饱和AlCl3溶液中滴加NaOH溶液至过量的图像是_____。
(3)表示向饱和石灰水中通入CO2至过量的图像是_____。
(4)表示向MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量的图像是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃X在标況下的密度1.25g/L,液态烃A摩尔质量为106g/mol,C是油脂皂化反应后的产物之一,具吸水保湿功能,D是有芳香气味的酯。它们之间的转化如下图所示(含有相同官能团的有机物通常具有相似的化学性质)
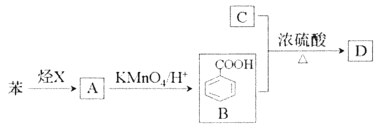
请回答
(1)烃X所含官能团的名称是_______。
(2)A→B的反应类型是_________。
(3)B与C按3:1反应生成D的化学方程式为_______。
(4)下列说法正确的是_______。
A.邻二溴苯只有一种结构,证明苯环结构中不存在单双键交替结构
B.上述六种有机物都能与H2发生加成反应
C.可用新制Cu(OH)2鉴别B、C、D
D.相同质量的苯与苯甲酸充分燃烧消耗等量的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
I.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变血红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为__________________________;
II.有部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理,回答下列问题:

(1)滤液A中含有主要的金属阳离子为:_________。
(2)原样品中氧元素的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有如下δ、γ、α三种晶体结构,三种晶体在不同温度下能发生转化。下列说法不正确的是( )
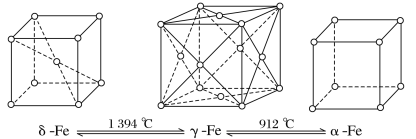
A.δ、γ、α三种晶体互为同分异构体
B.αFe晶体中与每个铁原子等距离且最近的铁原子有6个
C.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型不同,化学性质相同
D.γFe晶体为面心立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com