
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
I.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变血红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为__________________________;
II.有部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理,回答下列问题:

(1)滤液A中含有主要的金属阳离子为:_________。
(2)原样品中氧元素的质量为__________。
【答案】防止Fe2+ 被氧化 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 隔绝空气(或排除氧气对实验的影响) 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O Fe2+ 0.32g
【解析】
I.(1)配制0.1mol·L-1 的FeCl2溶液时,加入少量的铁屑可防止亚铁离子被氧化;
(2)根据实验现象,氯气与亚铁离子反应生成铁离子和氯离子;
(3)煤油的密度比水小,能够隔绝溶液与空气的接触;
(4)过氧化氢在酸性条件下与亚铁离子反应生成铁离子和水;
II.(1)根据流程,加入足量稀硫酸时,有固体剩余,则溶液中一定不含铁离子;
(2)根据质量守恒计算。
I.(1)配制0.1mol·L-1 的FeCl2溶液时,加入少量的铁屑可防止亚铁离子被氧化;
(2)根据实验现象,氯气与亚铁离子反应生成铁离子和氯离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)煤油的密度比水小,能够隔绝溶液与空气的接触,防止空气中的氧气的干扰;
(4)过氧化氢在酸性条件下与亚铁离子反应生成铁离子和水,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
II.(1)根据流程,加入足量稀硫酸时,有固体剩余,则溶液中一定不含铁离子,已知滤液A中无铜离子,则溶液中的主要金属阳离子为Fe2+;
(2)固体3.2g为氧化铁,则Fe元素的质量为![]() ×2×56=2.24g,铜的质量为3.2g,氧元素的质量=5.76-2.24-3.2=0.32g。
×2×56=2.24g,铜的质量为3.2g,氧元素的质量=5.76-2.24-3.2=0.32g。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2C2O4溶液中滴加0.2mol·L-1NaOH溶液,有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水]。根据图示,下列说法不正确的是( )
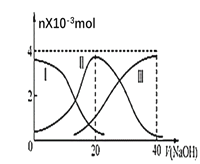
A.曲线Ⅱ代表的粒子是HC2O4-
B.当V(NaOH)=20mL时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)
C.NaHC2O4溶液:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4)
D.向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液pH可能逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志。下列说法错误的是

A.青铜是我国使用最早的合金、含铜、锡、铅等元素
B.青铜的机械性能优良,硬度和熔点均高于纯铜
C.铜器皿表面的铜绿可用明矾溶液清洗
D.“曾青(![]() )得铁则化为铜”的过程发生了置换反应
)得铁则化为铜”的过程发生了置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种酰胺类局麻药,某研究小组以A、E两种烃为有机原料,按以下路线合成M

已知:①![]() ;②
;②![]() ;
;
③![]() 。
。
请回答:
(1)化合物G的结构简式为______。
(2)下列说法不正确的是_________。
A.A→B为氧化反应
B.化合物G能与浓盐酸反应形成盐
C.化合物H与NaOH溶液反应最多消耗2molNaOH
D.局麻药M的分子式为C14H20N2O
(3)写出D+G→H的化学方程式:____________。
(4)写出满足下列条件的化合物F的所有同分异构体的结构简式________。
ⅰ.能与FeCl3溶液发生显色反应
ⅱ.能发生银镜反应
ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子
(5)该小组成员还提出另一种合成M的方案:化合物C与二乙胺[HN(CH2CH3)2]反应制取化合物X,X与G经一步反应即可制得药物M。请设计以烃A为原料制备化合物X的合成路线___________________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
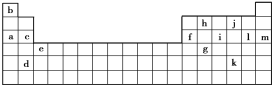
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)以上13种元素中,____(填写字母)元素原子失去核外第一个电子需要的能量最多。i在周期表中的位置_________。
(3)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向。
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1);
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量______________。
②表中X可能为以上13种元素中的_____(填写字母)元素。用元素符号表示X和j形成化合物的化学式_____。
③Y是周期表中_____族元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能。下表中给出了几种元素或离子的电子亲合能数据:
元素 | Li | Na | K | O |
| F |
电子亲合能kJ/mol |
|
|
| 141 |
|
|
下列说法不正确的是( )
A.电子亲合能越大,说明越容易得到电子
B.1mol基态的气态氟原子得到1mol电子成为氟离子时放出327.9kJ的能量
C.元素的第一电离能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。下列说法正确的是

A. 电解时发生反应的离子方程式为:NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B. 溶液X中大量存在的阴离子有Cl-、OH-
C. 可用饱和食盐水除去ClO2中的NH3
D. 可用明矾除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列七种元素,试按下述所给的条件推断。
①A、B、C 是同一周期的金属元素,已知原子核外有 3 个电子层,A 的原子半径在所属周期中最大且原子半径:A>B>C。
②D、E 是非金属元素,它们跟氢气化合可生成气态氢化物 HD 和 HE;在室温时,D 的单质是液体,E 的单质是固体。
③F 在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G 是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)F 的元素符号是_________。A 的名称是_________;B 位于周期表中第_________周期_________族;C的原子结构示意图为__________。
(2)E单质的颜色是_________。
(3)A元素与D元素形成的化合物的电子式为_________。
(4) 用电子式表示 G与A形成化合物的过程 : _________。
(5)在上述七种元素中,最高价氧化物对应水化物的碱性最强的是__________(填化学式下同),气态氢化物最稳定的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com