
【题目】元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能。下表中给出了几种元素或离子的电子亲合能数据:
元素 | Li | Na | K | O |
| F |
电子亲合能kJ/mol |
|
|
| 141 |
|
|
下列说法不正确的是( )
A.电子亲合能越大,说明越容易得到电子
B.1mol基态的气态氟原子得到1mol电子成为氟离子时放出327.9kJ的能量
C.元素的第一电离能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
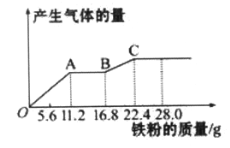
A. 第二份溶液中最终溶质为FeSO4
B. 原混合酸中NO3-物质的量为0.4mol
C. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为应对全球石油资源日益紧缺,提高煤的利用效率,我国开发了煤制烯烃技术,并进入工业化试验阶段。
(1)煤气化制合成气(CO和H2):![]()
![]() 该反应在高温下能自发进行,理由是_____。
该反应在高温下能自发进行,理由是_____。
(2)由合成气制甲醇:合成气CO和H2在一定条件下能发生如下反应:主反应Ⅰ.![]() ,副反应Ⅱ.
,副反应Ⅱ.![]() 。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
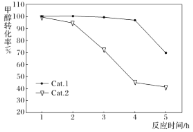
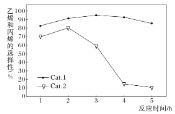
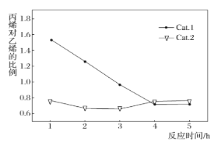
下列说法不正确的是______。
A. 反应进行一段时间后甲醇的转化率减小,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B. 使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚
C. 使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D. 不管使用Cat.1还是使用Cat2,都能提高活化分子的百分数
(3)已知:![]() 。以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
。以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
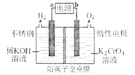
①a为电源的______(填“正极”或“负极”);
②该制备过程总反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为
A.4.4.gB.2.2gC.1.4gD.在2.2g与4.4g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
I.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变血红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为__________________________;
II.有部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理,回答下列问题:

(1)滤液A中含有主要的金属阳离子为:_________。
(2)原样品中氧元素的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
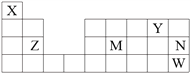
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
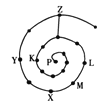
A. Y元素的氢化物的热稳定性比Z元素的氢化物差
B. K、Z两元素的氢化物的水溶液都显酸性
C. L、M、X三元素位于同一族
D. K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
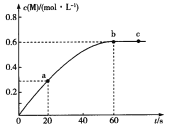
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com