
【题目】为应对全球石油资源日益紧缺,提高煤的利用效率,我国开发了煤制烯烃技术,并进入工业化试验阶段。
(1)煤气化制合成气(CO和H2):![]()
![]() 该反应在高温下能自发进行,理由是_____。
该反应在高温下能自发进行,理由是_____。
(2)由合成气制甲醇:合成气CO和H2在一定条件下能发生如下反应:主反应Ⅰ.![]() ,副反应Ⅱ.
,副反应Ⅱ.![]() 。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
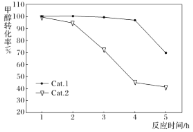
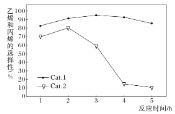
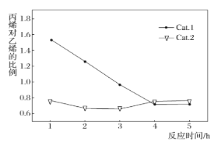
下列说法不正确的是______。
A. 反应进行一段时间后甲醇的转化率减小,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B. 使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚
C. 使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D. 不管使用Cat.1还是使用Cat2,都能提高活化分子的百分数
(3)已知:![]() 。以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
。以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
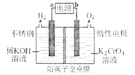
①a为电源的______(填“正极”或“负极”);
②该制备过程总反应的化学方程式为______。
【答案】![]() ,
,![]() C 负极
C 负极 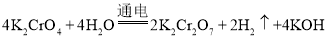
【解析】
(1)根据复合判据分析;
(2)A.催化剂失活后,会使副产物增多;
B.使用Cat.2随着反应的进行,副产物二甲醚增多,导致生成乙烯和丙烯的选择性下降;
C.由图3可知用Cat.1丙烯与乙烯的比值随时间的增长而减小;
D.催化剂能使反应的活化能降低,增大活化分子的百分数。
(3)①电解池连接电源正极的是阳极,连接电源负极的是阴极,得电子发生还原反应;
②根据电解池的图确定阴阳极,写出阴阳极电极反应,即可得总反应。
(1)由方程式可知,![]() >0,
>0,![]() >0,那么高温下
>0,那么高温下![]() =
=![]() -T
-T![]() <0,反应能自发进行;
<0,反应能自发进行;
(2)A.催化剂失活后,会使副产物增多,甲醇的额转化率降低,需要定期更换催化剂,A项正确;
B.使用Cat.2随着反应的进行,副产物二甲醚增多,导致生成乙烯和丙烯的选择性下降,B项正确;
C.由图3可知用Cat.1丙烯与乙烯的比值随时间的增长而减小,乙烯增多,用Cat.2乙烯的含量大于丙烯,乙烯增多,C项错误;
D.催化剂能使反应的活化能降低,增大活化分子的百分数,D项正确;
答案选C。
(3)①电解池连接电源正极的是阳极,连接电源负极的是阴极,得电子发生还原反应,氢气在溶液中得电子是电解池的阴极,所以a为负极;
②根据题意得,阴极:4H2O+4e-=4OH-+2H2↑,阳极:2H2O-4e-=4H++O2↑,4CrO42-+4H+=2Cr2O72-+2H2O,总反应为:4K2CrO4+4H2O![]() 2K2Cr2O7+2H2↑+4KOH
2K2Cr2O7+2H2↑+4KOH


科目:高中化学 来源: 题型:
【题目】下列物质的化学用语表达正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 羟基的电子式:![]()
C. 甲醇的球棍模型:![]() D. 乙酸的实验式:CH3COOH
D. 乙酸的实验式:CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.氯气溶于水:Cl2+H2O ![]() H++CI-+HClO
H++CI-+HClO
C.次氯酸钙中通二氧化硫:SO2+Ca2++H2O+2ClO-=CaSO3↓+2HClO
D.水玻璃(硅酸钠水溶液)中滴加醋酸:SiO32-+2H+=H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志。下列说法错误的是

A.青铜是我国使用最早的合金、含铜、锡、铅等元素
B.青铜的机械性能优良,硬度和熔点均高于纯铜
C.铜器皿表面的铜绿可用明矾溶液清洗
D.“曾青(![]() )得铁则化为铜”的过程发生了置换反应
)得铁则化为铜”的过程发生了置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应在工业上有广泛应用:2Al+Fe2O3 高温 2Fe+Al2O3
(1)在该反应中,Al作_______(氧化剂或还原剂);
(2)该反应中被氧化的元素是__;
(3)在上述反应方程式上标出电子转移的方向和数目。__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种酰胺类局麻药,某研究小组以A、E两种烃为有机原料,按以下路线合成M

已知:①![]() ;②
;②![]() ;
;
③![]() 。
。
请回答:
(1)化合物G的结构简式为______。
(2)下列说法不正确的是_________。
A.A→B为氧化反应
B.化合物G能与浓盐酸反应形成盐
C.化合物H与NaOH溶液反应最多消耗2molNaOH
D.局麻药M的分子式为C14H20N2O
(3)写出D+G→H的化学方程式:____________。
(4)写出满足下列条件的化合物F的所有同分异构体的结构简式________。
ⅰ.能与FeCl3溶液发生显色反应
ⅱ.能发生银镜反应
ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子
(5)该小组成员还提出另一种合成M的方案:化合物C与二乙胺[HN(CH2CH3)2]反应制取化合物X,X与G经一步反应即可制得药物M。请设计以烃A为原料制备化合物X的合成路线___________________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能。下表中给出了几种元素或离子的电子亲合能数据:
元素 | Li | Na | K | O |
| F |
电子亲合能kJ/mol |
|
|
| 141 |
|
|
下列说法不正确的是( )
A.电子亲合能越大,说明越容易得到电子
B.1mol基态的气态氟原子得到1mol电子成为氟离子时放出327.9kJ的能量
C.元素的第一电离能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
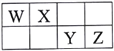
A. 原子半径大小:Z>Y>X
B. 最高价氧化物对应水化物的酸性:W>Y>Z
C. Y单质具有杀菌能力,Y与W可形成化合物WY2
D. W元素和氢元素形成的化合物可与Z单质反应,但不能与Z的氢化物反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com