
【题目】有下列七种元素,试按下述所给的条件推断。
①A、B、C 是同一周期的金属元素,已知原子核外有 3 个电子层,A 的原子半径在所属周期中最大且原子半径:A>B>C。
②D、E 是非金属元素,它们跟氢气化合可生成气态氢化物 HD 和 HE;在室温时,D 的单质是液体,E 的单质是固体。
③F 在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G 是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)F 的元素符号是_________。A 的名称是_________;B 位于周期表中第_________周期_________族;C的原子结构示意图为__________。
(2)E单质的颜色是_________。
(3)A元素与D元素形成的化合物的电子式为_________。
(4) 用电子式表示 G与A形成化合物的过程 : _________。
(5)在上述七种元素中,最高价氧化物对应水化物的碱性最强的是__________(填化学式下同),气态氢化物最稳定的是_________。
【答案】He 钠 三 ⅡA ![]() 紫黑色
紫黑色 ![]() 2F2+2H2O═4HF+O2 Na HF
2F2+2H2O═4HF+O2 Na HF
【解析】
①A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、B为Mg、C为Al;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,二者元素最低负化合价为-1,二者都处于ⅦA族,在室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;
③F在常温下是气体,性质稳定,是除氢气外最轻的气体,则F为He;
④G是除氢外原子半径最小的元素(不考虑稀有气体),则G为F元素。
(1)由上述分析可知,F的元素符号是He, A的名称是钠,B为Mg,位于周期表中第三周期ⅡA族,C为Al,原子结构示意图是![]() ;
;
(2)E为I,其单质颜色是紫黑色;
(3)A元素与D元素形成化合物为NaBr,其形成过程表示为![]() ;
;
(4)G的单质为氟气,与水反应的化学方程式是:2F2+2H2O═4HF+O2;
(5)在上述七种元素中,Na的金属性最强,最高价氧化物对应的水化物碱性最强的化学式是NaOH,F的非金属性最强,气态氢化物最稳定的化学式是HF。


科目:高中化学 来源: 题型:
【题目】写出下列反应的化学(离子)方程式
(1)HF不能装在玻璃瓶中,对应发生的化学方程式________
(2)NO2与一定量的O2混合通入水中,完全被水吸收的离子方程式________
(3)Pb的常见化合价是+2价和+4价,PbO2的某些化学性质与MnO2相似。写出实验室用PbO2与浓盐酸混合加热制氯气的化学方程式________
(4)SO2气体使溴水褪色的离子方程式________
(5)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1.(溶液呈碱性)反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl= |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
写出NaClO2溶液脱硝过程中主要反应的离子方程式 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
I.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变血红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为__________________________;
II.有部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理,回答下列问题:

(1)滤液A中含有主要的金属阳离子为:_________。
(2)原样品中氧元素的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
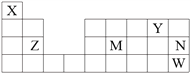
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
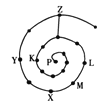
A. Y元素的氢化物的热稳定性比Z元素的氢化物差
B. K、Z两元素的氢化物的水溶液都显酸性
C. L、M、X三元素位于同一族
D. K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期;且原子序数依次增大。X、Z同主族;可形成离子化合物ZX;Y、M同主族;可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为___。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是___(写化学式);非金属气态氢化物还原性最强的是___(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1;写出X2M燃烧反应的热化学方程式:_____。
(5)ZX的电子式为________;ZX与水反应放出气体的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是
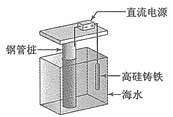
A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极
B.高硅铸铁的作用是作为损耗阳极材料和传递电流
C.通入的保护电流应该根据环境条件变化进行调整
D.通入的保护电流应使钢管桩表面腐蚀电流接近于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子检验的说法中正确的是
A.向某溶液中加入过量BaCl2溶液,产生白色沉淀,再加入过量稀盐酸,沉淀不溶解,则可推断该溶液中一定有SO42-
B.向某溶液中加入稀盐酸,若产生能使澄清石灰水变浑油的气体,则可推断该溶液中一定有CO32-
C.向某溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+
D.向某溶液巾先滴加氯水,再滴加KSCN溶液后显红色,则可推测该溶液中—定含有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com