
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是
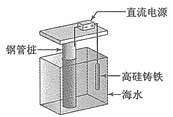
A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极
B.高硅铸铁的作用是作为损耗阳极材料和传递电流
C.通入的保护电流应该根据环境条件变化进行调整
D.通入的保护电流应使钢管桩表面腐蚀电流接近于零
科目:高中化学 来源: 题型:
【题目】物质M是一种酰胺类局麻药,某研究小组以A、E两种烃为有机原料,按以下路线合成M

已知:①![]() ;②
;②![]() ;
;
③![]() 。
。
请回答:
(1)化合物G的结构简式为______。
(2)下列说法不正确的是_________。
A.A→B为氧化反应
B.化合物G能与浓盐酸反应形成盐
C.化合物H与NaOH溶液反应最多消耗2molNaOH
D.局麻药M的分子式为C14H20N2O
(3)写出D+G→H的化学方程式:____________。
(4)写出满足下列条件的化合物F的所有同分异构体的结构简式________。
ⅰ.能与FeCl3溶液发生显色反应
ⅱ.能发生银镜反应
ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子
(5)该小组成员还提出另一种合成M的方案:化合物C与二乙胺[HN(CH2CH3)2]反应制取化合物X,X与G经一步反应即可制得药物M。请设计以烃A为原料制备化合物X的合成路线___________________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列七种元素,试按下述所给的条件推断。
①A、B、C 是同一周期的金属元素,已知原子核外有 3 个电子层,A 的原子半径在所属周期中最大且原子半径:A>B>C。
②D、E 是非金属元素,它们跟氢气化合可生成气态氢化物 HD 和 HE;在室温时,D 的单质是液体,E 的单质是固体。
③F 在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G 是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)F 的元素符号是_________。A 的名称是_________;B 位于周期表中第_________周期_________族;C的原子结构示意图为__________。
(2)E单质的颜色是_________。
(3)A元素与D元素形成的化合物的电子式为_________。
(4) 用电子式表示 G与A形成化合物的过程 : _________。
(5)在上述七种元素中,最高价氧化物对应水化物的碱性最强的是__________(填化学式下同),气态氢化物最稳定的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
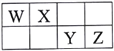
A. 原子半径大小:Z>Y>X
B. 最高价氧化物对应水化物的酸性:W>Y>Z
C. Y单质具有杀菌能力,Y与W可形成化合物WY2
D. W元素和氢元素形成的化合物可与Z单质反应,但不能与Z的氢化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某密闭容器中充入1.6 molH2与1.0molCO,发生如下可逆反应并达到平衡:H2(g)+CO(g)C(s)+H2O(g)+Q kJ(Q>0).若压缩容器体积并同时升高温度,达到新平衡后,关于下列物理量的变化情况叙述错误的是( )
A.反应速率一定增大
B.平衡常数一定减小
C.混合气体的平均摩尔质量可能减小
D.H2O(g)的体积分数可能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷铜制电路板的蚀刻液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的蚀刻液。
①蚀刻过程屮的离子方程式为______________________________。
②蚀刻结束后,可以通过两步先分离出铜,冉实现FcCl3溶液再生。
i.第1步所加试剂和操作分别为____________________________。
ii.第2步转化可加入的物质是_________________________(填一种即可)。
(2)H2O2也常用来做铜制电路板蚀刻液,使用时加入盐酸或氨水将其配制成酸性或碱性蚀刻液。应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:

①蚀刻铜板主要反应的离子方程式为_______________________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 C.NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程屮需控制反应的温度,当温度髙于80℃时,产品颜色发暗,其原因可能是______________________。
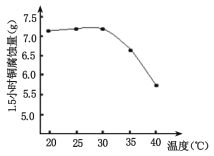
④如图是研究碱性蚀刻液的温度对锏腐蚀量的实验结果,升高温度,腐蚀量变化的原因______________________。
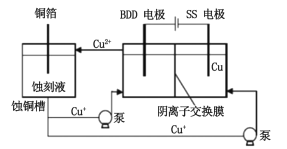
(3)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氡氧自由基(HO·),请写出BDD电极上的电极反应__________________,进一步溶液中反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
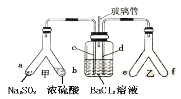
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和工业生产中有着重要的应用。
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题
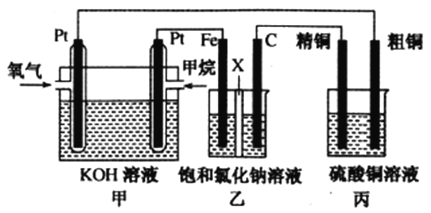
(1)甲烷燃料电池负极反应式是______________________。
(2)石墨(C)极的电极反应式为______________________。
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为___________L;丙装置中阴极析出铜的质量为___________g,一段时间后烧杯中c(Cu2+)___________(填“增大”、“减小”或“不变”)
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:
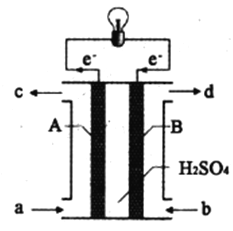
(4)从a口加入___________(填名称)。H+移动方向是___________(填“A到B”或“B到A”)
(5)A极发生的电极反应式:______________________。
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com