
【题目】下列说法正确的是
A. 凡是放热反应都是自发的,凡是吸热反应都是非自发的
B. 自发反应熵一定增大,非自发反应熵一定减小或不变
C. 自发反应在适当条件下才能实现
D. 自发反应在任何条件下都能实现
科目:高中化学 来源: 题型:
【题目】由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;
④过滤;⑤浓缩结晶。其先后顺序正确的是
A. ②④⑤③① B. ③②④①⑤ C. ③④②⑤① D. ②④③⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若Y原子的最外层电子数是次外层电子数的3倍.下列说法错误的是( )
![]()
A. 气态氢化物的热稳定性:X<Y
B. 最高价氧化物对应水化物的酸性:W>Z>X
C. X、Y元素均存在同素异形体
D. W的单质具有漂白性,能使干燥的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明溶液中,能大量共存的离子组是
A. K+、MnO4―、SO42―B. Al3+、Cl―、SO42―
C. Na+、CH3COO―、H+D. OH―、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲烷化再利用。
请回答:
⑴已知:2Al2O3(s)=4Al(g)+3O2(g) △H1=3351 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-221 kJ·mol-1
2Al(g) + N2(g)=2AlN(s) △H3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是_____,该反应自发进行的条件____________。
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
反应II CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2

①下列说法不正确的是_____
A. △H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为________(用a、V表示)。
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。________

据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1molL1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是()
A. 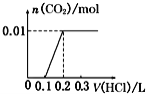 B.
B. 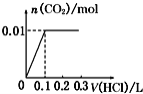 C.
C. 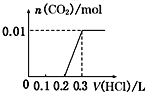 D.
D. 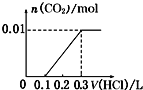
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol/L的HA溶液中![]() =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.![]()
B.![]()
C.c(H+)与c(OH-)的乘积
D.c(OH-)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com