
【题目】25℃时,0.1 mol/L的HA溶液中![]() =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.![]()
B.![]()
C.c(H+)与c(OH-)的乘积
D.c(OH-)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
【答案】(1)弱电解质 强电解质 (2)HA ![]() H++A- 10-12 (3)B
H++A- 10-12 (3)B
(4)碱性 A-+H2O ![]() HA+OH- c(B+)> c(A-) >c(OH-)>c(H+)
HA+OH- c(B+)> c(A-) >c(OH-)>c(H+)
(5)81.8mL
【解析】
试题分析:(1)25℃时,0.1mol?L-1的某酸HA中,如果该酸是强酸,氢离子浓度为0.1mol/L,氢氧根离子浓度为:10-13mol/L,则![]() =1012>1010,所以该酸是弱酸;0.01mol?L-1的BOH溶液pH=12,溶液中氢氧根离子的浓度为0.01mol/L,说明BOH完全电离,属于强电解质;(2)弱酸在水溶液里存在电离平衡,其电离方程式为HA
=1012>1010,所以该酸是弱酸;0.01mol?L-1的BOH溶液pH=12,溶液中氢氧根离子的浓度为0.01mol/L,说明BOH完全电离,属于强电解质;(2)弱酸在水溶液里存在电离平衡,其电离方程式为HA![]() H++A-; (3)A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:
H++A-; (3)A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:![]() 比值增大,错误;B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则
比值增大,错误;B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则![]() 减小,正确;C.c(H+)与c(OH-)的乘积为水的离子积,温度不变,水的离子积常数不变,错误;D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,错误。(4) (5)
减小,正确;C.c(H+)与c(OH-)的乘积为水的离子积,温度不变,水的离子积常数不变,错误;D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,错误。(4) (5)


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是放热反应都是自发的,凡是吸热反应都是非自发的
B. 自发反应熵一定增大,非自发反应熵一定减小或不变
C. 自发反应在适当条件下才能实现
D. 自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是

A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.金属铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag
C氢氧化铜固体投入稀硝酸:Cu(OH)2+2H+=Cu2++2H2O
D.石灰石溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:

(1)“O”点导电能力为0的理由是___________________ ;
(2)a、b、c三点溶液的pH由小到大的顺序为___;
(3)a、b、c三点溶液中CH3COO物质的量最大的是___;
(4)若使c点溶液中c(CH3COO)增大,溶液的pH也增大,可采取得措施是(写出两种方法):__________________、_________________________________
(5)现有pH均为3的醋酸、硫酸两瓶溶液:
a.设两种溶液的物质的量浓度依次为c1、c2,则其关系式 ___________(用<,>,= 表示,下同)
b.取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下装置探究氨气的性质:
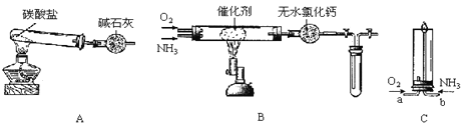
(1)制备氨气:用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是___;碱石灰的作用是__________________
(2)氨的催化氧化:将产生的氨气与过量的氧气通到装置B中,用酒精喷灯加热催化剂至红热,熄灭酒精喷灯,反应仍能继续进行,说明反应是___(填“吸”或“放”)热反应;化学方程式为_____________________.当试管内气体变为红棕色后,停止反应,立即关闭B中两个活塞,并将试管浸入冰水中,试管内气体颜色变___(填“深”或“浅”),原因是_____________________.
(3)点燃氨气:已知“氨气可在纯氧中安静地燃烧,变成氮气”。将氧气和氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:①两气体通入的先后顺序是___;②氨气燃烧的化学方程式是________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均为有机化合物,根据图中的信息,回答下列问题:

(1)环状化合物A的相对分子质量为82,含碳87.80%,含氢12.20%。B的一氯代物仅有一种,B的结构简式为__________________;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______________________;
(3)由A生成D的反应类型是________,由D生成E的反应类型是________;
由D反应生成E的化学方程式为_____________________________________;
(4)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
![]() ,则由E和A反应生成F的化学方程式为_________________;
,则由E和A反应生成F的化学方程式为_________________;
(5)H中含有的官能团是_____________(填名称,下同),I中含有的官能团是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com