
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图1所示:


(1)如图2所示,过滤操作中的一处错误是___________。
(2)高温焙烧时,用于盛放固体的仪器名称是_____________。
(3)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

①装置B中盛放饱和NaCl溶液,该装置的主要作用是__________。
②F 中试剂是浓硫酸,若用一件仪器装填适当试剂后也可起到F和G的作用,则该仪器及所装填的试剂为_______。
③装置E的作用是__________。
④制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式____________。
【答案】漏斗下端尖嘴未紧贴烧杯内壁 坩埚 除去HCl 装有碱石灰的干燥管 收集氯化铝产品 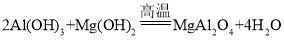
【解析】
(1)用过滤操作的“两低三靠”来分析;
(2)高温焙烧通常选用坩埚来盛放固体,注意坩埚有多种材质。
(3)除去氯气中的氯化氢气体,首选饱和食盐水;从F和G的作用上考虑替代试剂;从题给的流程上判断高温焙烧时的反应物和生成物并进行配平。
(1)漏斗下方尖端应当贴紧烧杯壁,以形成液体流,加快过滤速度;
(2)坩埚通常可用于固体的高温焙烧;
(3)①浓盐酸易挥发,用饱和食盐水可除去浓盐酸挥发出的HCl气体,并降低氯气的溶解损耗;
②F装置的作用是吸收水分,防止水分进入收集瓶,G装置的作用是吸收尾气中的氯气,防止污染环境。用装有碱石灰的球形干燥管可以同时实现上述两个功能;
③图中已标注E是收集瓶,其作用是收集D装置中生成的氯化铝;
④从整个流程图可以看出,用氨水从溶液中沉淀出Al(OH)3和Mg(OH)2,再通过高温焙烧来制取目标产物MgAl2O4,所以反应物为Al(OH)3和Mg(OH)2,生成物为MgAl2O4,该反应的化学方程式为: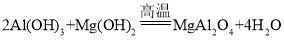
。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向100mL含氯化氢14.6g的盐酸溶液中,放入5.6g纯铁粉,反应进行到2min末收集到氢气1.12 L(标准状况),在此后又经过4min,铁粉完全溶解。若不考虑溶液体积的变化,则:
(1)前2min内用FeCl2表示的平均反应速率是______________。
(2)后4min内用HCl表示的平均反应速率是________________。
(3)前2min与后4min相比,反应速率__________较快,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PdCl2广泛用作催化剂和一些物质的检测试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。

(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为_____________。
(2)对工艺流程图中的滤液处理办法最好的是:______
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为_____。
(4)赶硝,是将残余的NO3-浓度降低到不大于0.04%。实验数据记录如下:

处理1吨Pd,需要用到HCl和MxOy的总体积至少为_______m3(合理选择表格里相关数据计算)。
(5)煅烧过程发生分解反应,化学方程式为:_______________________________。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。 写出反应原理中第一步的化学方程式:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3A(g)+2B(g)![]() 2C(g)+3D(g)。在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol。四个选项中错误的是( )
2C(g)+3D(g)。在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol。四个选项中错误的是( )
A. 达平衡时,①途径的反应速率vA不等于②途径的反应速率vA
B. ①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同
C. ①、②都达到平衡时,体系内混合气体的组成百分比相同
D. 达平衡时,①途径所得混合气的密度为②途径所得混合气密度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应 Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)设计成如图所示原电池。下列说法中正确的是( )

A. 电极X是正极,其电极反应为Cu-2e-== Cu2+
B. 银电极板质量逐渐减小,Y溶液中c(Ag+)增大
C. 当X电极质量变化0.64 g时,Y溶液质量变化2.16 g
D. 外电路中电流由银极流向铜极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(s)+B(g) ==3C(g)+4D(g)反应中,表示该反应速率最快的是
A. υ(A)=1.5 mol·L1·s1B. υ(B)=0.5 mol·L1·s1
C. υ(C)=0.8 mol·L1·min1D. υ(D)=4mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,pH=7的(NH4)2SO4与NH3·H2O的混合溶液中,c(NH4+)与c(SO42-)之比是
A.小于2∶1B.大于2∶1C.等于2∶1D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A. pH=3的硫酸溶液中所含H+的数目为10-3NA
B. 7.8g Na2O2与足量SO2完全反应,转移的电子数为0. 1NA
C. 标准状况下,11.2 L丙烷中含有的共用电子对数目为5NA
D. 0.1mol NH3与0.1 mol HC1在密闭容器中充分反应后,气体的分子总数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com