
【题目】25 ℃时,pH=7的(NH4)2SO4与NH3·H2O的混合溶液中,c(NH4+)与c(SO42-)之比是
A.小于2∶1B.大于2∶1C.等于2∶1D.无法判断
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
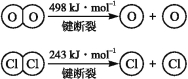
(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图1所示:


(1)如图2所示,过滤操作中的一处错误是___________。
(2)高温焙烧时,用于盛放固体的仪器名称是_____________。
(3)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

①装置B中盛放饱和NaCl溶液,该装置的主要作用是__________。
②F 中试剂是浓硫酸,若用一件仪器装填适当试剂后也可起到F和G的作用,则该仪器及所装填的试剂为_______。
③装置E的作用是__________。
④制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能有NO3﹣、Cl﹣、I﹣和Fe3﹢中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断该溶液中 ( )
A.含有NO3﹣,不含Fe3﹢B.含有NO3﹣、Cl﹣、I﹣
C.含I﹣,但不能确定是否含Cl﹣D.含有Fe3﹢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有相同官能团的有机物化学性质相似。下列5个有机物中,能够发生酯化、加成和氧化3种反应的是
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH
④CH3CH2CH2OH ⑤![]()
A. ①③⑤B. ②④⑤
C. ①③④D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由废铁制备FeCl2并测定FeCl2的含量。主要过程如下所示:

I.按上图所示过程制备FeCl3·6H2O。
(1)用离子方程式表示过程②中稀硝酸的作用:_________________________。
(2)在过程②中要不断向溶液中补充盐酸,目的是___________________。
(3)步骤③的操作是_______________________ 。
Ⅱ.由FeCl3·6H2O制得干燥FeCl2的过程如下所示:
①向盛有FeCl3·6H2O的容器中加入SOCl2,加热,获得无水FeCl3;
②将无水FeCl3置于反应管中,通入过程①中产生的气体一段时间后加热,生成FeCl2;
③收集FeCl2,保存备用。
(4)上述过程2中产生FeCl2的化学方程式是________________________。
Ⅲ.测定FeCl2的含量。
分析方法:①取a g样品配制成100 mL溶液;②用移液管吸取所配溶液5.00 mL,放入500 mL、锥形瓶内并加水200 mL;③加硫酸锰溶液20.00mL,用0.1 mol/L酸性高锰酸钾标准溶液滴定,终点时消耗酸性高锰酸钾标准溶液V mL。
(5)滴定终点的判断依据是______________________。
(6)滴定时如果不加入硫酸锰很容易导致测定结果偏高,则加入硫酸锰可使测定结果准确的原因可能是_____________________ 。
(7)若所配溶液中![]() (FeC12) (g/L) =kV(式中V——消耗的酸性高锰酸钾标准溶液的毫升数),则k=_____________(保留四位有效数字)。
(FeC12) (g/L) =kV(式中V——消耗的酸性高锰酸钾标准溶液的毫升数),则k=_____________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在密闭容器中充入1molSO2与2molNO2发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率__________(填“增大”、“不变”或“减小”,下同);
(2)恒温恒压下,在反应平衡体系中再充入一定量SO2,则NO2的平衡浓度_________;
(3)恒容下,升高温度,上述反应的平衡常数K为_________;
(4)恒容下,降低温度,重新达到平衡时![]() _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中,800 ℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是________。
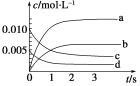
(2)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v(NO)逆=2v(O2)正
d.容器内的密度保持不变
(3)能够使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体
b.增大O2的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com