
【题目】有机化合物是工业上合成锅炉防腐剂的中间体,E(![]() )的一种合成路线如下:
)的一种合成路线如下:
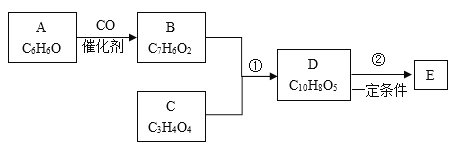
已知:
①R1CHO+R2CH2COOH![]() R1CH=CR2COOH;
R1CH=CR2COOH;
②RCH=C(COOH)2![]() RCH=CHCOOH+CO2
RCH=CHCOOH+CO2
回答下列问题:
(1)有机物A的化学名称为___________。
(2)1mol有机物C最多能与2molNaHCO3反应,C的结构简式为_____,有机物B中含有官能团的名称为_______。
(3)有机物D能发生的化学反应有____(填字母)。
a.加成反应b.消去反应c.水解反应d.氧化反应
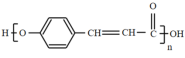
(4)写出E在一定条件下生成聚酯的化学方程式:_______。
(5)有机物F分子比化合物B多了一个CH2原子闭,满足下列条件的F的同分异构体有_____种(不含立体异构),其中核磁共振氢谱为五组峰的物质的结构简式为_______。
①遇氯化铁溶液发生显色反应;②能发生银镜反应。
(6)已知:CH3CH=CH2+Cl2![]() ClCH2CH=CH2+HCl。以丙烯为原料(其他无机物任选)涉及制备化合物C的合成路线__________________________。
ClCH2CH=CH2+HCl。以丙烯为原料(其他无机物任选)涉及制备化合物C的合成路线__________________________。
【答案】苯酚 HOOCCH2COOH 羟基、醛基 ad n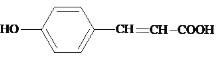
![]()
 +(n-1)H2O 13
+(n-1)H2O 13  CH3CH=CH2
CH3CH=CH2![]() ClCH2CH=CH2
ClCH2CH=CH2![]() ClCH2CH2CH2Cl
ClCH2CH2CH2Cl![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH![]() OHCCH2CHO
OHCCH2CHO![]() HOOCCH2COOH
HOOCCH2COOH
【解析】
E的分子式为C9H8O3,D的分子式为C10H8O5,D和E的分子式相差CO2,根据已知②,可知D到E发生脱羧反应,结合E的结构简式,可知D的结构简式为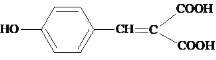 。根据已知①,可知C的结构简式为HOOCCH2COOH,B的结构简式为
。根据已知①,可知C的结构简式为HOOCCH2COOH,B的结构简式为 ,结合B和A的分子式,可知A和CO发生加成反应,生成B,A的结构简式为
,结合B和A的分子式,可知A和CO发生加成反应,生成B,A的结构简式为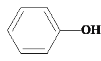 。
。
(1)A的结构简式为 ,名称为苯酚;
,名称为苯酚;
(2)1molC能和2molNaHCO3反应,说明其有2个-COOH,结合已知②,可知C的结构简式为HOOCCH2COOH;
B的结构简式为 ,其官能团名称为羟基和醛基;
,其官能团名称为羟基和醛基;
(3)D的结构简式为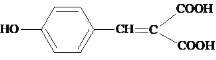 ,含有碳碳双键和苯环,可以发生加成反应;酚羟基不能发生消去反应;分子中没有酯基,也没有卤素原子,不能发生水解反应;分子中含有碳碳双键,可以发生氧化反应;综上能发生的反应有ad;
,含有碳碳双键和苯环,可以发生加成反应;酚羟基不能发生消去反应;分子中没有酯基,也没有卤素原子,不能发生水解反应;分子中含有碳碳双键,可以发生氧化反应;综上能发生的反应有ad;
(4)E的分子中具有羟基和羧基,在发生缩聚反应时,-OH脱去H,-COOH脱去-OH,化学方程式为n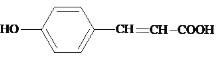
![]()
 +(n-1)H2O;
+(n-1)H2O;
(5)有机物F分子比化合物B多了一个CH2原子闭,满足下列条①遇氯化铁溶液发生显色反应,说明分子中含有酚羟基,②能发生银镜反应,说明分子中有-CHO;苯环上的取代基有可能为-OH、-CHO、-CH3,有10种同分异构体;苯环上有-OH、-CH2CHO,有3种同分异体;则共有13种;其中核磁共振氢谱为五组峰的物质的结构简式为 ;
;
(6)-COOH可由-CH2OH经过连续2次氧化得到,-OH可由-Cl水解得到,结构C的结构简式,需要在丙烯的1号和3号碳上引入氯原子,利用已知的反应和碳碳双键的加成反应,可引入氯原子,则合成路线为CH3CH=CH2![]() ClCH2CH=CH2
ClCH2CH=CH2![]() ClCH2CH2CH2Cl
ClCH2CH2CH2Cl![]() HOCH2CH2CH2OH
HOCH2CH2CH2OH![]() OHCCH2CHO
OHCCH2CHO![]() HOOCCH2COOH。
HOOCCH2COOH。


科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为___,检验溶液中还有Fe3+的试剂是___。
(2)工业上制取漂白粉的化学反应方程式为___,漂白粉在空气中表现漂白性的原理是___,除去氯气中混有的氯化氢气体的方法是将气体通过___溶液中。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为___。
(4)玻璃烧制过程中发生的反应有___。
(5)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2物质的量之比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是__(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体的结构式:___;C、N、O的第一电离能由大到小的顺序为__(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是___。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,1mol[Cu(NH3)2]+中含有σ键的数目___。则其中碳原子的杂化轨道类型是__,NH3分子的价电子对互斥理论模型是___。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
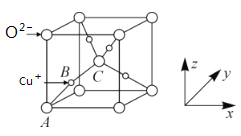
①若坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C的坐标参数为__;
),则C的坐标参数为__;
②若阿伏加德罗常数为NA,该晶胞的边长为apm,则晶体的密度为___gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答问题:

(1)硬质玻璃管里发生反应的化学方程式为______。当三氧化二铬红热时,要移去酒精灯,原因是:______。
(2)圆底烧瓶里的实验现象是______,鼓入空气的作用是______。
(3)实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色______。
(4)实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式:______。
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后______(填一种操作名称)。
(6)实验室里保存浓硝酸要用棕色瓶的原因是__________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,其中B、C、D 焰色反应均为黄色,而A的焰色反应为紫色,B、D和盐酸反应均得到C,将固体B加热分解可得到D,若在D的溶液中通入一种无色无味气体,又可得到B的溶液;若A的溶液滴加到FeCl2溶液中,先出现白色沉淀迅速变成灰绿色,最后变成红褐色沉淀E。
(1)试推断各物质的化学式:
A:___ B:___ C:___
(2)按要求写出下列方程式:
①D与盐酸反应的离子方程式:___;
②E固体受热分解的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)生产中曾用铝热反应焊接钢轨,铝与氧化铁反应的化学方程式为___________。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝表现______性;氢氧化铝的电离方程式_______________。
(3)铁、铝、铁铝合金三种物质中硬度最大的是_________________。
(4)铝锭能做成铝壶烧水,表现铝的导热性和______________,表面破损的铝制品,放久了破损处会有一层“白毛”产生,“白毛”既能溶于酸又能溶于碱溶液,写出形成“白毛”的化学方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为_____________,在上述反应的生成物中,属于分子晶体的的电子式__________。
(2)反应中单质物质的原子核外共有______种不同形状的电子云,该原子最外层电子的能量 ______上述方程式中同主族的另一元素原子的最外层电子能量(选填“高于”“低于”或“等于”)。
(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是___(选填编号)。
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,Na2CO3溶液比Na2SO4溶液碱性______(选填“强”或“弱”)用离子方程式说明原因:__________________。(选填“冷”或“热”)的纯碱水易于除油污,简要说明原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
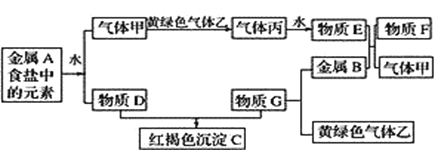
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在热的稀硫酸中溶解了11.4g FeSO4固体,加入足量 KNO3溶液,使Fe2+全部转化成Fe3+,并放出NO气体。
①反应中氧化产物是(填化学式)______,FeSO4恰好完全反应时,转移电子的物质的量是_____。
②配平该反应的方程式:
____FeSO4+____KNO3+____H2SO4=_____K2SO4+____Fe2(SO4)3+____NO↑+____H2O
③用单线桥法表示下面反应中的电子转移方向和数目:_________________
2Mg+CO2![]() 2MgO+C。
2MgO+C。
(2)硫代硫酸钠可用作脱氯剂,已知25.0mL0.10mol/L Na2S2O3溶液恰好把标准状况下112mLCl2完全转化为Cl-,则S2O32-将转化成______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com