
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为___,检验溶液中还有Fe3+的试剂是___。
(2)工业上制取漂白粉的化学反应方程式为___,漂白粉在空气中表现漂白性的原理是___,除去氯气中混有的氯化氢气体的方法是将气体通过___溶液中。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为___。
(4)玻璃烧制过程中发生的反应有___。
(5)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2物质的量之比是___。
【答案】2Fe3++Cu=2Fe2++Cu2+ KSCN溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+CO2+H2O=2HClO+CaCO3 饱和食盐水 1:1 SiO2+Na2CO3![]() Na2SiO3+CO2 1:3
Na2SiO3+CO2 1:3
【解析】
(1)用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2,由反应物、生成物及电子、原子守恒书写离子方程式;
(2)工业上是利用氯气和石灰乳反应生成氯化钙、次氯酸钙和水;Ca(ClO)2和溶有CO2的H2O溶液反应生成HClO;氯化氢极易溶于水,氯气在饱和食盐水中溶解性减小;
(3)铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,这两个反应中都是铝失电子,且都是由0价升高到+3价,由电子守恒,可求出需要铝的物质的量;
(4)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钙和碳酸钠与二氧化硅在高温条件下反应生成硅酸盐和二氧化碳;
(5)根据n=![]() 计算混合气体的总的物质的量,设CO的物质的量为x mol,CO2的物质的量为y mol,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算二者物质的量之比。
计算混合气体的总的物质的量,设CO的物质的量为x mol,CO2的物质的量为y mol,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算二者物质的量之比。
(1) 用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2,由反应物、生成物及电子、原子守恒可知反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,检验Fe3+溶液的试剂是KSCN溶液,滴入KSCN溶液,溶液变红色证明含铁离子;
(2) 工业上是利用氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H2O;漂白粉的有效成分Ca(ClO)2溶于水,和水中溶解的CO2反应生成HClO,HClO有强氧化性,具有漂白性,发生反应的化学方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3↓;因氯气与水发生:Cl2+H2OH++Cl-+HClO,氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体;
(3) 铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,这两个反应中都是铝失电子,由转移电子守恒知,需要铝的物质的量之比为1:1;
(4)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钙和碳酸钠与二氧化硅在高温条件下反应生成硅酸盐和二氧化碳,发生反应的化学方程式为SiO2+Na2CO3![]() Na2SiO3+CO2或SiO2+CaCO3
Na2SiO3+CO2或SiO2+CaCO3![]() CaSiO3+CO2;
CaSiO3+CO2;
(5)标准状况下,混合气体的物质的量为:![]() =0.3mol;设CO的物质的量为x mol,CO2的物质的量为y mol,则:x+y=0.3、28x+44y=12,解得:x=0.075mol,y=0.225mol,此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3。
=0.3mol;设CO的物质的量为x mol,CO2的物质的量为y mol,则:x+y=0.3、28x+44y=12,解得:x=0.075mol,y=0.225mol,此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将9.5gMgCl2溶于水配成1L溶液,所得溶液的物质的量浓度为___mol/L,500mL该溶液中所含Cl-的物质的量为___mol。
(2)含有2NA个氢原子的CH4的质量为___g。
(3)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用下列序号填空:能导电的是___(填选项);属于电解质的是___(填选项)。
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应在工业上有广泛应用:2Al+Fe2O3 高温 2Fe+Al2O3
(1)在该反应中,Al作_______(氧化剂或还原剂);
(2)该反应中被氧化的元素是__;
(3)在上述反应方程式上标出电子转移的方向和数目。__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
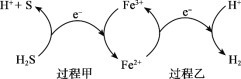
过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:
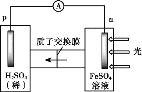
ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
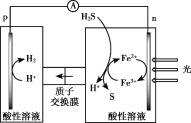
进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图所示。在玻璃管中放入铁粉与石棉绒的混合物,加热,并通入水蒸气。用试管收集产生的干燥气体,并靠近火焰点火,观察现象。下列说法错误的是( )
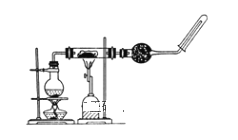
A.圆底烧瓶中盛装的是水,该装置受热后提供水蒸气
B.在圆底烧瓶内加入碎瓷片加快化学反应速率
C.实验时应先点燃酒精灯,后点燃酒精喷灯
D.石棉绒作铁粉的载体,防止铁粉被吹入导管而引起堵塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物是工业上合成锅炉防腐剂的中间体,E(![]() )的一种合成路线如下:
)的一种合成路线如下:
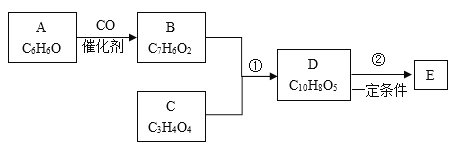
已知:
①R1CHO+R2CH2COOH![]() R1CH=CR2COOH;
R1CH=CR2COOH;
②RCH=C(COOH)2![]() RCH=CHCOOH+CO2
RCH=CHCOOH+CO2
回答下列问题:
(1)有机物A的化学名称为___________。
(2)1mol有机物C最多能与2molNaHCO3反应,C的结构简式为_____,有机物B中含有官能团的名称为_______。
(3)有机物D能发生的化学反应有____(填字母)。
a.加成反应b.消去反应c.水解反应d.氧化反应
(4)写出E在一定条件下生成聚酯的化学方程式:_______。
(5)有机物F分子比化合物B多了一个CH2原子闭,满足下列条件的F的同分异构体有_____种(不含立体异构),其中核磁共振氢谱为五组峰的物质的结构简式为_______。
①遇氯化铁溶液发生显色反应;②能发生银镜反应。
(6)已知:CH3CH=CH2+Cl2![]() ClCH2CH=CH2+HCl。以丙烯为原料(其他无机物任选)涉及制备化合物C的合成路线__________________________。
ClCH2CH=CH2+HCl。以丙烯为原料(其他无机物任选)涉及制备化合物C的合成路线__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com