
【题目】某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图所示。在玻璃管中放入铁粉与石棉绒的混合物,加热,并通入水蒸气。用试管收集产生的干燥气体,并靠近火焰点火,观察现象。下列说法错误的是( )
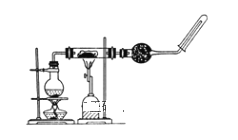
A.圆底烧瓶中盛装的是水,该装置受热后提供水蒸气
B.在圆底烧瓶内加入碎瓷片加快化学反应速率
C.实验时应先点燃酒精灯,后点燃酒精喷灯
D.石棉绒作铁粉的载体,防止铁粉被吹入导管而引起堵塞
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )
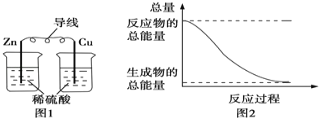
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,A是氯气的发生装置,B、C是净化气体的装置,B装置中装有饱和食盐水,D中装铁丝网;反应后E的底部有棕色固体聚集;F是碱液用于吸收多余气体的装置。
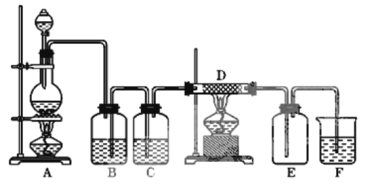
(1)上述装置中有一处错误,请指出是___处(用字母表示)。
(2)B装置的作用是___,C装置中需要加入___。
(3)写出A中发生反应的化学方程式___。
(4)如果A中产生氯气2.24L(标准状况),则被氧化的HCl的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为___,检验溶液中还有Fe3+的试剂是___。
(2)工业上制取漂白粉的化学反应方程式为___,漂白粉在空气中表现漂白性的原理是___,除去氯气中混有的氯化氢气体的方法是将气体通过___溶液中。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为___。
(4)玻璃烧制过程中发生的反应有___。
(5)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2物质的量之比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5mol/L的硫酸溶液450mL,需用量筒量取质量分数98%、密度1.84g/cm3的浓硫酸的体积为___mL,如果实验室有15mL、20mL、50mL量筒,应最好选用___mL量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是___。
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是__(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)配制时,其正确的操作顺序是___(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有水的烧杯中加入浓硫酸稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(5)下面操作造成所配稀硫酸溶液浓度偏高的是__(填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
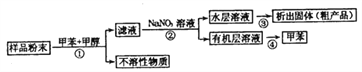
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量比为14 :15的N2和NO混合,则混合气体中氮原子和氧原子的个数比为________
(2)同温同压下,质量相同的五种气体:①CO2 ②H2 ③O2 ④CH4 ⑤SO2所占的体积由大到小的顺序是(填序号,下同)_________________;
(3)已知19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为______________________ ;
(4)在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶1,则在含有2mol SO42-的混合物中,MgSO4的质量是________________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是__(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体的结构式:___;C、N、O的第一电离能由大到小的顺序为__(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是___。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,1mol[Cu(NH3)2]+中含有σ键的数目___。则其中碳原子的杂化轨道类型是__,NH3分子的价电子对互斥理论模型是___。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
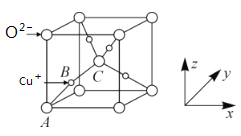
①若坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C的坐标参数为__;
),则C的坐标参数为__;
②若阿伏加德罗常数为NA,该晶胞的边长为apm,则晶体的密度为___gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为_____________,在上述反应的生成物中,属于分子晶体的的电子式__________。
(2)反应中单质物质的原子核外共有______种不同形状的电子云,该原子最外层电子的能量 ______上述方程式中同主族的另一元素原子的最外层电子能量(选填“高于”“低于”或“等于”)。
(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是___(选填编号)。
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,Na2CO3溶液比Na2SO4溶液碱性______(选填“强”或“弱”)用离子方程式说明原因:__________________。(选填“冷”或“热”)的纯碱水易于除油污,简要说明原因:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com