
【题目】(1)在热的稀硫酸中溶解了11.4g FeSO4固体,加入足量 KNO3溶液,使Fe2+全部转化成Fe3+,并放出NO气体。
①反应中氧化产物是(填化学式)______,FeSO4恰好完全反应时,转移电子的物质的量是_____。
②配平该反应的方程式:
____FeSO4+____KNO3+____H2SO4=_____K2SO4+____Fe2(SO4)3+____NO↑+____H2O
③用单线桥法表示下面反应中的电子转移方向和数目:_________________
2Mg+CO2![]() 2MgO+C。
2MgO+C。
(2)硫代硫酸钠可用作脱氯剂,已知25.0mL0.10mol/L Na2S2O3溶液恰好把标准状况下112mLCl2完全转化为Cl-,则S2O32-将转化成______________
【答案】Fe2(SO4)3 0.075mol 6 2 4 1 3 2 4 ![]() SO32-
SO32-
【解析】
(1)①根据元素化合价升高的反应物是还原剂,其对应产物为氧化产物;FeSO4~Fe2+~Fe3+~e-,转移电子n(e-)=n(FeSO4),据此计算;
②根据化合价升降总数相等和质量守恒来配平方程式;
③单线桥的箭头始于反应物中失去电子的元素,箭头指向反应物中得到电子的元素,在桥上标明电子的得失电子数目。
(2)根据反应中Na2S2O3失去电子,Cl2中的Cl原子得到电子,反应过程中电子转移数目等于元素化合价升降数目分析。
(1)①在反应中FeSO4中铁元素的化合价由+2价升高为+3价,作还原剂,所以对应的产物Fe2(SO4)3是氧化产物,11.4g FeSO4固体的物质的量n(FeSO4)=![]() =0.075mol,由FeSO4~Fe2+~Fe3+~e-,可知转移电子的物质的量n(e-)=n(FeSO4)=0.075mol;
=0.075mol,由FeSO4~Fe2+~Fe3+~e-,可知转移电子的物质的量n(e-)=n(FeSO4)=0.075mol;
②在反应中FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,根据化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4= K2SO4+3Fe2(SO4)3+2NO↑+4H2O;
③在反应2Mg+CO2![]() 2MgO+C中,Mg失去电子,CO2中的C得到电子,反应过程中电子转移数目为2×2e- ,用单线桥表示为
2MgO+C中,Mg失去电子,CO2中的C得到电子,反应过程中电子转移数目为2×2e- ,用单线桥表示为![]() ;
;
(2)n(Cl2)=![]() =0.005mol,反应过程中假设反应后S元素化合价为+x价,根据元素化合价升降总数相等可知:0.005×2=0.10mol/L×0.025L×2(x-2),解得x=+4价,所以反应后Na2S2O3将转化成Na2SO3,即含有S元素的离子为SO32-。
=0.005mol,反应过程中假设反应后S元素化合价为+x价,根据元素化合价升降总数相等可知:0.005×2=0.10mol/L×0.025L×2(x-2),解得x=+4价,所以反应后Na2S2O3将转化成Na2SO3,即含有S元素的离子为SO32-。


科目:高中化学 来源: 题型:
【题目】有机化合物是工业上合成锅炉防腐剂的中间体,E(![]() )的一种合成路线如下:
)的一种合成路线如下:
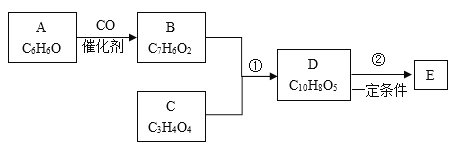
已知:
①R1CHO+R2CH2COOH![]() R1CH=CR2COOH;
R1CH=CR2COOH;
②RCH=C(COOH)2![]() RCH=CHCOOH+CO2
RCH=CHCOOH+CO2
回答下列问题:
(1)有机物A的化学名称为___________。
(2)1mol有机物C最多能与2molNaHCO3反应,C的结构简式为_____,有机物B中含有官能团的名称为_______。
(3)有机物D能发生的化学反应有____(填字母)。
a.加成反应b.消去反应c.水解反应d.氧化反应
(4)写出E在一定条件下生成聚酯的化学方程式:_______。
(5)有机物F分子比化合物B多了一个CH2原子闭,满足下列条件的F的同分异构体有_____种(不含立体异构),其中核磁共振氢谱为五组峰的物质的结构简式为_______。
①遇氯化铁溶液发生显色反应;②能发生银镜反应。
(6)已知:CH3CH=CH2+Cl2![]() ClCH2CH=CH2+HCl。以丙烯为原料(其他无机物任选)涉及制备化合物C的合成路线__________________________。
ClCH2CH=CH2+HCl。以丙烯为原料(其他无机物任选)涉及制备化合物C的合成路线__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. c(NH4+)/c(NH3·H2O)先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1曰,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态Cr原子的价电子排布式为___。
(2)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。
)检验Fe3+。
①第一电离能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ数目为___。
③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___。
④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___。
(3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
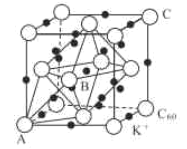
(4)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为___,晶胞参数为428pm,则晶体密度为___gcm-3(NA表示阿伏加德罗常数的值,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(aNaHSO2bHCHOcH2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
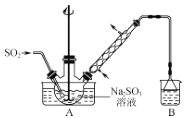
步骤1:在如图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___。
(2)步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:___。
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是___。
(3)冷凝管中回流的主要物质除H2O外,还有___(填化学式)。
(4)步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是___。
(5)步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,___,900℃煅烧。(已知:Zn与铝类似,能与NaOH溶液反应;Zn2+开始沉淀的pH为5.9,沉淀完全的pH为8.9,pH>11时,Zn(OH)2能生成ZnO22-。实验中须使用的试剂有1.0molL-1NaOH溶液、1.0molL-1HCl溶液、水)
(6)产物组成测定实验:
准确称取1.5400g样品,溶于水配成l00mL溶液;取25.00mL样品溶液经AHMT分光光度法测得溶液吸光度A=0.4000(如图);另取25.00mL样品溶液,加入过量碘水后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到BaSO4固体0.5825g。

①样品溶液HCHO浓度为___molL-1。
②通过计算确定aNaHSO2·bHCHOcH2O的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中回收铁红。流程如下:

(1)操作a是________,在实验室进行该操作需要的玻璃仪器有烧杯、漏斗和_______。
(2)试剂①是_______,固体II是_________(填化学式)。
(3)红褐色沉淀的成分是_________;写出白色沉淀转化为红褐色沉淀的化学方程式:______________。
(4)溶液II中铁元素的存在形式是_______(填离子符号),如何用实验证明:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确是
A.上述反应涉及到的物质中,Fe的还原性最强
B.上述反应涉及到的物质中,NaNO2的氧化性最强
C.上述反应中,铁是还原剂,NaNO2和NaOH是氧化剂
D.![]() 的氧化性大于
的氧化性大于![]() 的氧化性
的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
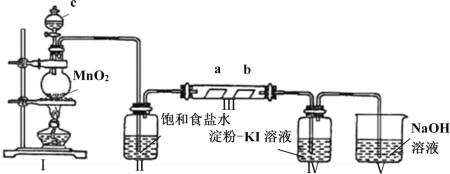
(1)装置Ⅰ中仪器c的名称是_______________,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为_______________________________________________________。
(2)装置Ⅱ的作用是________________________。
(3)实验过程中装置Ⅳ中的实验现象为______________________________。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与III之间添加下图中的_______装置(填序号)。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com