
����Ŀ���±���Ԫ�����ڱ���ǰ�����ڼ����еIJ���Ԫ�أ���ش��������

��1��a��f��gԪ������������ˮ���������ǿ������˳����____(�û�ѧʽ��ʾ)��
��2����Ԫ�ؿ�������Ԫ���γ�_____(��ѡ�����)�Ȼ�ѧ����
A.���Թ��ۼ� B.�Ǽ��Թ��ۼ� C.��� D.���Ӽ�
��3��d��f��h����Ԫ�ؿ��γ�һ����ǿ��ԭ�ԵĻ�����û������к��зǼ��Լ����仯ѧʽΪ_____����û������ˮ��Һ�м������ᷢ�������绯��Ӧ�����ӷ���ʽΪ______��
��4������������ij����Ԫ�ؿ��γ�һ�ֳ������л��ܼ�����������ȡ��ˮ�еĵⵥ�ʣ���ȡ���л������ɫΪ______����Һʱ�л���Ӧ��______(�����¿������������Ͽڵ�����)�����л��ܼ��ĵ���ʽ��______��
���𰸡�NaOH>LiOH>Al(OH)3 AD Na2S2O3 S2O32+2H+=S�� +SO2��+H2O ��ɫ �¿����� 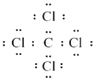
��������
����ͼʾԪ�����ڱ���֪��aΪLiԪ�أ�bΪB��cΪCԪ�أ�dΪOԪ�أ�eΪFԪ�أ�fΪNaԪ�أ�gΪAlԪ�أ�hΪSԪ�أ�iΪClԪ�أ��ݴ˽��Ԫ�������ɼ�Ԫ�ػ��������ʽ��
��1��������Խǿ������������ˮ�������Խǿ��������������ˮ���������ǿ������˳��ΪNaOH>LiOH>Al(OH)3��
��2��HԪ���������ǽ���Ԫ���γɵĻ�ѧ��Ϊ���Թ��ۼ���H��Na���γ����Ӽ�����AD��ȷ��
�ʴ�Ϊ��AD��
��3��O��Na��S����Ԫ�ؿ��γ�һ����ǿ��ԭ�ԵĻ�����û������к��зǼ��Լ����仯ѧʽΪNa2S2O3����û������ˮ��Һ�м�����������S���ʡ����������ˮ���÷�Ӧ�����ӷ���ʽΪ��S2O32+2H+=S�� +SO2��+H2O��
�ʴ�Ϊ��Na2S2O3��S2O32+2H+=S�� +SO2��+H2O��
��4������������ij����Ԫ�ؿ��γ�һ�ֳ������л��ܼ�����������ȡ��ˮ�еĵⵥ�ʣ����л��ܼ�Ϊ���Ȼ�̼�����Ȼ�̼���ܶȴ���ˮ������ȡ���л������ɫ��ɫ����Һʱ�л���Ӧ�ӷ�Һ©�����¿����������Ȼ�̼Ϊ���ۻ���������ʽΪ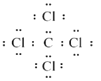 ��
��
�ʴ�Ϊ����ɫ���¿�������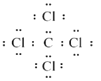 ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ�����������������У�A��C��B��D�ֱ���ͬ����Ԫ�أ�AԪ�ص�ԭ�Ӱ뾶����������Ԫ����ԭ�Ӱ뾶��С�ģ�B��D��Ԫ�ص�ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵�2��������Ԫ�����γɵĵ�����A��B���������壬C��D�����ǹ��塣
(1)д������Ԫ�ص����ƣ�B________________��C______________��
(2)д��DԪ�������ڱ��е�λ��___________________________
(3)�õ���ʽ��ʾC2D���γɹ��̣�_______________________________
(4)д����B��C��Ԫ�����γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵĵ���ʽ_______������_______(��������������������)��������ڵĻ�ѧ����������______________________��д������ˮ��Ӧ�����ӷ���ʽ_______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һЩԭ�ӵ�2p�ܼ���3d�ܼ��е����Ų������������Υ���˺��ع�����ǣ� ��
�� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]() ��
��![]()
A. �٢�B. �٢ڢ�C. �ڢܢ�D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��b��c��d�ĸ������缫���йصķ�Ӧװ�ü����ַ�Ӧ�������£�
ʵ��װ�� |
|
|
|
|
����ʵ������ | a��������Сb���������� | ��Һ�е�SO42-��b���ƶ� | d���ܽ�c����������� | ������a������d�� |
�ɴ˿��ж������ֽ����Ļ��˳����
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�����ʢ��ǿ��ԭ���£�N2H4����ǿ������Һ̬˫��ˮ�������ǻ�Ϸ�Ӧʱ������������������ˮ���������ų������ȡ���֪0.4molҺ̬��������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256.652kJ��������
��д����������ĵ���ʽ________��
�Ʒ�Ӧ���Ȼ�ѧ����ʽΪ_________��
�Ǵ˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ŵ���_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨп�̸ɵ�صĹ�����ͼ��ʾ�����ط�Ӧ�ķ���ʽΪ��Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)����˵������ȷ����( )

A.ʯī������
B.п����������Ӧ
C.��ع���ʱ�����Ӵ�ʯī����������п
D.�����ĵ缫��ӦΪ��NH4++MnO2+e����MnO(OH)+NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaH2PO2�����ڻ�ѧ��������ͨ����Ӧ��P4��3NaOH��3H2O==3NaH2PO2��PH3�����Ƶã�����PH3��P�Ļ��ϼ�Ϊ-3������˵����ȷ����
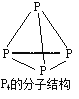
A.P4�����к��еĹ��ۼ��Ǽ��Լ�
B.31g P4������P��P�������ʵ���Ϊ6 mol
C.��Ӧ�л�ԭ���������������ʵ���֮��Ϊ1��3
D.��Ӧ����2.24 L PH3����״������ת�Ƶ�����ĿΪ0.3��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ء���Ԫ���ڹ�ҵ������Ҫ��Ӧ�á���ش��������⣺
��1��Ca����Co����________(����)
A. ���������� B. ԭ�Ӱ뾶
C. ��һ������ D. δ�ɶԵ�����
��2����X�������䷨�ⶨ���֣���������417�����϶ѻ���ʽ������ͼ��ͼ��ʾ����öѻ���ʽ����_____�����öѻ���ʽ�µľ�������Ϊa cm������ԭ�ӵİ뾶Ϊ______pm��
��3��Co3+�����Լ�ǿ����ˮ��Һ���ױ���ԭ��Co2+�����ڰ�ˮ�п��ȶ����ڣ���ԭ����________��
��4����֪��������У���λ���к���һ����λԭ�ӵ������Ϊ�������壻һ��������������������������λԭ�ӵ������Ϊ������塣[Co(NO3��)4]2����Co2+����λ��Ϊ4�����������и�Ԫ�ص�һ�������ɴ�С��˳��_______����Ԫ�ط��ţ���1mol�������к��Ҽ���ĿΪ_________��
��5����Co��ij����ﻯѧʽΪCoCl3��3NH3��Ϊ������ṹ�����м��Է�����___�֡�
�ڸ����������NaOH��Һ�з�����Ӧ�������������ͷų����壬�÷�Ӧ�Ļ�ѧ����ʽ_________��
��6��NaCl������50~300GPa�ĸ�ѹ�º�Cl2��Ӧ�������γ�һ���¾��壬��������������ͼ��ʾ(����ΪCl��С��ΪNa)��
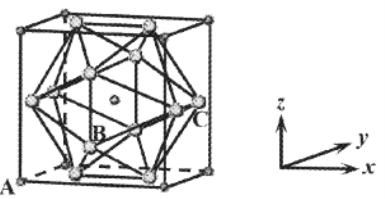
����A��ԭ������Ϊ(0,0,0)��C��ԭ������Ϊ��1,![]() ,
,![]() ������B��ԭ������Ϊ________��
������B��ԭ������Ϊ________��
�ھ����У�Cl���ɵĶ��������_____�������ε��棬��Cl���ڵ�Na����Ϊ______��
��7����������ṹ����ͼ��������������I�ͺ�II��С�������4�����ɣ��仯ѧʽΪ_____��������Al3+ռ��O2���γɵ�_____�����϶��NAΪ����٤��������ֵ���軯ѧʽ��Ӧ��Ħ������ΪMg/mol��������������ܶȼ���ʽΪ_________g/cm3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��нϴ�����Cl����![]() ��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
�ٵμ�Mg��NO3��2��Һ���ڹ��ˣ��۵μ�AgNO3��Һ���ܵμ�Ba(NO3)2��Һ
A.�٢ڢܢڢ�B.�ܢڢ٢ڢ�C.�٢ڢۢڢ�D.�ܢڢۢڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com