
| Cu |
| O2 |
| 1.92g |
| 64g/mol |
| Cu |
| O2 |
| 0.06mol |
| 4 |
| Cu |
| O2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
| ||
| △ |
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省漳州市八校高三第三次联考理综化学试卷(解析版) 题型:填空题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:

⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式????????????????? ?????? 。
⑵如图所示,过滤操作中的一处错误是?????? ????????? ????????? 。判断流程中沉淀是否洗净所用的试剂是??????????? 。高温焙烧时,用于盛放固体的仪器名称是???? ?????????? ?????? 。

⑶在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式_______?? ______________
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

装置B中盛放饱和NaCl溶液,该装置的主要作用是??? ????????????? ; F中试剂的作用是???? ?????? ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为???????????????? ?? 。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为??????????????? g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:实验题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:


(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式????????????? 。
(2)如图所示,过滤操作中的一处错误是????????????? ?? 。

判断流程中沉淀是否洗净所用的试剂是??????????? 。高温焙烧时,用于盛放固?? 体的仪器名称是??????????? 。
(3)在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_________________沉淀(填化学式),生成该沉淀的离子方程式_____________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

装置B中盛放饱和NaCl溶液,该装置的主要作用是????????? ;F中试剂的作用是???????? ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为??????????????????? 。
(5)将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为??????????????????????? g。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ||
| △ |
| ||
| △ |
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
| ||
| △ |
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应。向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。
![]()
![]() 乙组: Cu CuO CuSO4
乙组: Cu CuO CuSO4
![]()
![]()
![]() 丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
![]() 丁组: Cu CuSO4
丁组: Cu CuSO4
(1)甲组实验用一个化学反应方程式表示: ;
使反应变快的可能原因是 ;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为 、
过滤并洗涤晶体,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在四组方案中, 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:
CuSO4![]() CuO+SO2↑+SO3↑+O2↑
CuO+SO2↑+SO3↑+O2↑
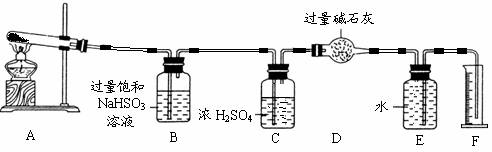 为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;
②实验结束时干燥管D总质
量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
(3)装置B的作用是 。
(4)装置C的作用是 。
(5)为减少测量气体体积引起的误差,应注意的事项有:
① 装置内气体的温度应恢复到室温,
② 调节量筒使其液面与E装置中的液面持平,
③ 。
(6)通过计算,推断出该条件下反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com