
【题目】[化学——选修2:化学与技术]
高锰酸钾(![]() )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
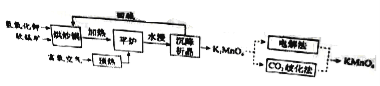
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
【答案】(1)扩大接触面积,加快化学反应速率;
(2)2MnO2+O2+4KOH![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(3)增大反应物的浓度,可使化学反应速率加快,同时使反应物的转化率增大;
(4) ① K2CO3;②MnO42--e-=MnO4-;③3:2;
(5)95.62%。
【解析】
试题(1) MnO2的状态是固体,对于有固体参加的化学反应,可通过增大其反应接触面积的方法提高反应速率,故要将其粉碎成细小的颗粒;(2) 根据流程图可知,在“平炉”中MnO2、KOH、O2在加热时反应产生K2MnO4,结合质量守恒定律可知,另外一种物质是H2O,则发生的化学方程式为2MnO2+O2+4KOH![]() 2K2MnO4+2H2O ;(3)由于上述反应中氧气是气体,在“平炉”中加压,就可以使反应物氧气的浓度增大,根据外界条件对化学反应速率的影响,增大反应物的浓度,可以使化学反应速率加快;任何反应都具有一定的可逆性,增大压强,可以使化学平衡向气体体积减小的正反应方向移动,故可以提高原料的转化率; (4) ①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2,根据质量守恒定律可知,另外一种生成物是K2CO3,根据氧化还原反应中的电子守恒及反应的原子守恒,可得该反应的化学方程式是:3K2MnO4+ 2CO2= 2KMnO4+MnO2+K2CO3;②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-。电极反应式是:MnO42--e-=MnO4-;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-。所以阴极逸出的气体是H2;总反应方程式是:2K2MnO4+2H2O
2K2MnO4+2H2O ;(3)由于上述反应中氧气是气体,在“平炉”中加压,就可以使反应物氧气的浓度增大,根据外界条件对化学反应速率的影响,增大反应物的浓度,可以使化学反应速率加快;任何反应都具有一定的可逆性,增大压强,可以使化学平衡向气体体积减小的正反应方向移动,故可以提高原料的转化率; (4) ①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2,根据质量守恒定律可知,另外一种生成物是K2CO3,根据氧化还原反应中的电子守恒及反应的原子守恒,可得该反应的化学方程式是:3K2MnO4+ 2CO2= 2KMnO4+MnO2+K2CO3;②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-。电极反应式是:MnO42--e-=MnO4-;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-。所以阴极逸出的气体是H2;总反应方程式是:2K2MnO4+2H2O![]() 2KMnO4+2H2↑+2KOH;③根据“电解法”方程式2K2MnO4+ 2H2O
2KMnO4+2H2↑+2KOH;③根据“电解法”方程式2K2MnO4+ 2H2O![]() 2KMnO4+2H2↑+2KOH 可知K2MnO4的理论利用率是100%;而在“CO2歧化法” 3K2MnO4+2CO2 = 2KMnO4+MnO2+K2CO3中,K2MnO4的理论利用率是2/3,所以二者的理论利用率之比为3:2;(5)根据离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知KMnO4与草酸反应的关系式是:2 KMnO4~5H2C2O4。配制的溶液的浓度为:
2KMnO4+2H2↑+2KOH 可知K2MnO4的理论利用率是100%;而在“CO2歧化法” 3K2MnO4+2CO2 = 2KMnO4+MnO2+K2CO3中,K2MnO4的理论利用率是2/3,所以二者的理论利用率之比为3:2;(5)根据离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知KMnO4与草酸反应的关系式是:2 KMnO4~5H2C2O4。配制的溶液的浓度为:![]() 。则1.0800g样品中含KMnO4的物质的量为:n=
。则1.0800g样品中含KMnO4的物质的量为:n=![]() KMnO4的质量为:m=" 0.006536mol" × 158g/mol =1.03269g。故其纯度为:
KMnO4的质量为:m=" 0.006536mol" × 158g/mol =1.03269g。故其纯度为:![]() ×100%=95.62%。
×100%=95.62%。


科目:高中化学 来源: 题型:
【题目】25℃条件下,向10 mL 0.1 mol·Lˉ1的HR溶液中逐滴滴入0.1 mol·Lˉ1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是( )
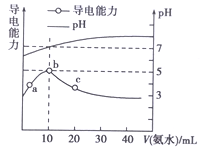
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7说明NH4R没有发生水解
C. c点溶液存在c(NH4+)>c(Rˉ)、c(OHˉ)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OHˉ)=KW=1.0×10ˉ14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素,霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
Ⅰ. 2NO(g)+O2(g)![]() 2NO2(g) H=-113.0 kJ mol-1
2NO2(g) H=-113.0 kJ mol-1
Ⅱ. 2SO2(g)+O2(g)![]() 2SO3(g) H=-196.6 kJ mol-1
2SO3(g) H=-196.6 kJ mol-1
二氧化硫通常在二氧化氮的存在下,进一步被氧化,生成三氧化硫。
①写出NO2和SO2反应的热化学方程式为______。
②反应Ⅱ自发进行的条件是______(填“较高温”“较低温”或“任何温度”)。
(2)提高2SO2(g)+O2(g) ![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是______。
②在①中条件下,反应达到平衡后改变下列条件,能使SO2的转化率提高的是______(填字母)。
a.温度和容器体积不变,充入1.0mol He
b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(3)电解NO制备NH4NO3,其工作原理如图所示。阳极的电极反应式为_____________________________,为使电解产物全部转化为NH4NO3,需补充物质是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。某课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到 海带灰悬浊液,再按以下实验流程提取单质碘:

(1)实验操作①的名称:__________。
(2)用于灼烧海带的实验仪器是_________。(选填字母)
A.烧杯 B.蒸发皿 C.试管 D.坩埚
(3)操作③中所用的有机溶剂可以是__________。(选填字母)
A.苯(沸点80℃) B.四氯化碳(沸点76.8℃)
C.酒精(沸点 78℃) D.裂化汽油(易与碘反应)
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
上述操作的正确顺序是:____________(用字母表示)
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏,如图是利用水浴加热的方式进行 蒸馏的实验装置,其中错误的有_________处。(碘的沸点184.3℃)

(6)该实验进行蒸馏时,使用水浴加热的优点是________,最后晶态碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
![]()
![]() 滤液
滤液![]()
![]()
![]()
![]() 纯净氯化钾溶液
纯净氯化钾溶液
(1)A的化学式是_______,B的化学式是______,C的名称是_______。
(2)加入过量A的目的是________。
(3)操作Ⅰ的名称是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y;X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子。则这四种金属的活动性由强到弱的顺序为下列的
A.X>Y>Z> M B.X>Z>M>Y C.M>Z>X>Y D.X>Z>Y>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是

A. 由图可知:T1<T2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D. T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好完全沉淀(浓度等于1.0×105mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如下图所示。下列说法不正确的是
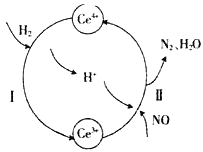
A. 反应I的离子反应方程式为2Ce4++H2=2Ce3++2H+
B. 反应II中氧化剂与还原剂的物质的量之比为1:2
C. 反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+)
D. 反应过程中混合溶液内Ce3+和Ce4+离子的总数一定保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com