
【题目】25℃条件下,向10 mL 0.1 mol·Lˉ1的HR溶液中逐滴滴入0.1 mol·Lˉ1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是( )
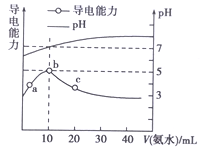
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7说明NH4R没有发生水解
C. c点溶液存在c(NH4+)>c(Rˉ)、c(OHˉ)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OHˉ)=KW=1.0×10ˉ14
【答案】B
【解析】A.a~b点导电能力增强,说明反应后溶液中离子浓度增大,也证明HR在溶液中部分电离,为弱酸,故A正确;B、弱离子在水溶液中会发生水解反应,根据A知,HR是弱电解质,且一水合氨是弱电解质,所以NH4R是弱酸弱碱盐,b点溶液呈中性,且此时二者的浓度、体积都相等,说明HR和一水合氨的电离程度相等,所以该点溶液中铵根离子和酸根离子水解程度相等,故B错误;C.c点溶液的pH>7,说明溶液呈碱性,溶液中c(OH-)>c(H+),再结合电荷守恒得c(NH4+)>c(R-),故C正确;D.离子积常数只与温度有关,温度不变,离子积常数不变,所以b-c任意点溶液均有c(H+)c(OH-)=Kw=1.0×10-14mol2L-2,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 硫化氢在空气中燃烧 D. 高温煅烧硫铁矿
(2)装置C的作用是______________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、________、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(4)①写出SO2与FeCl3溶液反应的离子方程式:______________________________;
②请设计实验方案检验反应后A中Fe2+生成______________________________;
③本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Ca、Sr、Ba是按原子序数由小到大的顺序排列的第ⅡA族元素。已知:①Mg(OH)2难溶于水,而Ca(OH)2微溶于水;②MgSO4溶于水,而CaSO4微溶于水。下列推测中,不正确的是( )。
A. Sr(OH)2溶解于水 B. SrSO4易溶于水
C. BaSO4不溶于水 D. Ba(OH)2比Ca(OH)2更易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017天津]用沉淀滴定法快速测定NaI等碘化物溶液中c(I),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L1 AgNO3溶液(过量),使I完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有__________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________________________。
(3)滴定应在pH<0.5的条件下进行,其原因是___________________________________。
(4)b和c两步操作是否可以颠倒________________,说明理由________________________。
(5)所消耗的NH4SCN标准溶液平均体积为_____mL,测得c(I)=_________________ mol·L1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为________________________。
(7)判断下列操作对c(I)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_______________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现用98%浓硫酸(ρ=1.84 g/mL)配制200 mL氢离子浓度为1.00 mol/L的稀硫酸,下列有关的说法正确的是( )
A. 需要量取浓硫酸的体积为21.7 mL
B. 将浓硫酸沿玻璃棒缓慢的加入容量瓶中
C. 若洗涤装浓硫酸的量筒并转移到容量瓶中,则浓度偏大
D. 在量取浓硫酸时,若皮肤上沾上浓硫酸,应立即用大量水冲洗,并涂上硼酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北魏贾思勰《齐民要术·作酢法》这样描述:“乌梅去核,一升许肉,以五升苦酒渍数日,曝干,擣(同“捣”)作屑.欲食,辄投水中,即成醋尔.”下列有关醋的主要成分乙酸的说法中正确的是
A. 是一元酸 B. 0.lmol/L乙酸溶液的pH=l
C. 与乙醇反应时O-H键断裂 D. 含有双键,可使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【河南省2017届诊断卷(A)】铜及其化合物是一类重要的物质。回答下列有关问题:
(l)某试管底部附着一层致密的铜,向其中滴加10 mL 稀硫酸时,无明显现象,再加入0.1g KNO3, 振荡,可观察到有气泡生成,除此外还可观察到的现象是__________,生成的气体是___(填化学式)。
(2)铜与浓硫酸加热反应,实验结束后观察到试管底部有黑色物质形成,溶液呈蓝色,通过检验知该黑色物质为Cu2S。写出浓硫酸与Cu反应生成Cu2S的化学方程式:___________。
(3)工业上利用合成气(主要成分为CO、CO2和H2)、空气,在铜基催化剂作用下,可合成甲醇。已知:25℃,101kPa下:
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol;
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-676kJ/mol。
写出CO2和H2生成甲醇等气态产物的热化学方程式:________________。
(4)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的碳的氧化物。铜液吸收CO的化学方程式为
Cu(NH3)2Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3CO]Ac(aq) △H
[Cu(NH3)3CO]Ac(aq) △H
① 如果要提高上述反应的反应速率,可以采取的措施是______(填字母)。
a.增压 b.增加NH3的浓度 c.增大Cu(NH3)2Ac浓度
d.降温 e.减小[Cu(NH3)3CO]Ac浓度
② 合成氨反应中,在不增减反应物或生成物的情况下,不断改变反应条件,反应速率与时间的关系如图所示:

t4~t5改变的条件可能是__________,H2转化率最高的时间段是________。若某温度下,3xmolH2和xmolN2反应,在1L的密闭容器中, H2的最高转化率为50%,则该温度下2NH3(g)![]() 3H2(g)+N2(g)的平衡常数K=_____(保留两位小数)。
3H2(g)+N2(g)的平衡常数K=_____(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI+5KIO3+3H2S=3I2+3K2SO4+3H2O,下列说法正确的是
A. 还原产物只有12,氧化产物只有K2SO4 B. 氧化剂和还原剂物质的量之比为5:4
C. 3molH2S可还原5mol的KIO3 D. 2.5molKIO3发生反应,转移25NA个e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com