
【题目】Mg、Ca、Sr、Ba是按原子序数由小到大的顺序排列的第ⅡA族元素。已知:①Mg(OH)2难溶于水,而Ca(OH)2微溶于水;②MgSO4溶于水,而CaSO4微溶于水。下列推测中,不正确的是( )。
A. Sr(OH)2溶解于水 B. SrSO4易溶于水
C. BaSO4不溶于水 D. Ba(OH)2比Ca(OH)2更易溶于水
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去。A是一种碳酸氢盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味气体。
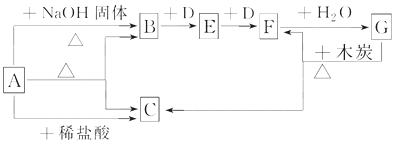
回答下列问题:
(1)物质A的名称是________________。
(2)写出物质B的一种主要用途______________。
(3)写出实验室制取气体B的化学方程式__________________________。
写出工业上制取气体B的化学方程式__________________________。
(4)写出反应的化学方程式:
B→E______________________________。
F→G____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,其中含有Cl-为1.8mol,Na+为2mol,Mg2+为0.5mol,则SO42-的物质的量为( )
A. 0.6mol B. 0.7mol C. 1.2mol D. 1.0mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分某化学兴趣小组在实脸室模拟侯德榜制碱法制备纯碱。主要步骤如下:
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 .
(2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (用离子符号表示)。
(3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是
A. 铍的原子半径小于硼的原子半径
B. 氯化铍难溶于水
C. 氢氧化铍的碱性比氢氧化钙的弱
D. 单质铍与冷水反应迅速产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.1mol/L 硫酸铁溶液和 100mL 0.2mol/L硫酸钠溶液中,SO42-的物质的量浓度之比是
A. 1:2 B. 3:1 C. 3:2 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,反应速率加快是由催化剂引起的( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
C.固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀
D.双氧水中加入少量MnO2,即可迅速放出气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃条件下,向10 mL 0.1 mol·Lˉ1的HR溶液中逐滴滴入0.1 mol·Lˉ1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是( )
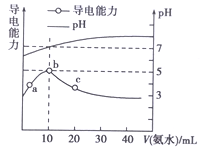
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7说明NH4R没有发生水解
C. c点溶液存在c(NH4+)>c(Rˉ)、c(OHˉ)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OHˉ)=KW=1.0×10ˉ14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:
①HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖固体
⑥Ca(OH)2 ⑦氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述物质中属于电解质的有_________,非电解质的有____________。(填序号)
(2)向⑦中逐滴滴加①的水溶液,看到的现象___________________________________。
(3)②在水溶液中的电离方程式为___________________________________。
(4)向⑩中滴加少量⑧的水溶液,反应离子方程式________________________________。
(5)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的含Al(OH)3的胃药(如胃舒平),能治疗胃酸过多,请写出其反应的离子方程式:_________________________。
(6)药物“达喜”的化学成分是铝和镁的碱式盐,也可用于治疗胃酸过多。取一定量该碱式盐,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时恰好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为_____。 (已知: ![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com