
【题目】如图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去。A是一种碳酸氢盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味气体。
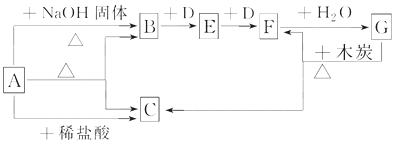
回答下列问题:
(1)物质A的名称是________________。
(2)写出物质B的一种主要用途______________。
(3)写出实验室制取气体B的化学方程式__________________________。
写出工业上制取气体B的化学方程式__________________________。
(4)写出反应的化学方程式:
B→E______________________________。
F→G____________________________________。
【答案】 碳酸氢铵 制氮肥(或制硝酸或作制冷剂) 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O N2+3H2
CaCl2+2NH3↑+2H2O N2+3H2![]() 2NH3 4NH3+5O2
2NH3 4NH3+5O2![]() 4NO+6H2O 3NO2+H2O === 2HNO3+NO
4NO+6H2O 3NO2+H2O === 2HNO3+NO
【解析】A是一种酸式盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体是NH3,是A和氢氧化钠反应生成,说明A中含铵根离子,B和D发生两部连续反应,说明D是无色无味的气体O2,E为NO,F为NO2,G为HNO3,G和C反应生成二氧化氮和二氧化碳,所以C为CO2,A是一种酸式盐,确定A为碳酸氢铵;
(1)根据上面的分析可知,A为碳酸氢铵;
(2)物质B是NH3,工业用途可以工业制硝酸(或制氮肥,制氨水等);
(3)B是NH3,实验室制取气体B的化学方程式为2NH4Cl+Ca(0H)2![]() CaCl2+2NH3↑+2H2O,工业上制取气体B是用氢气和氮气高温高压催化剂条件下合成氨,反应的化学方程式为:N2+3H2
CaCl2+2NH3↑+2H2O,工业上制取气体B是用氢气和氮气高温高压催化剂条件下合成氨,反应的化学方程式为:N2+3H2![]() 2NH3;
2NH3;
(4)B-→E反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,F→G反应的化学方程式为3NO2+H2O=2HNO3+NO。
4NO+6H2O,F→G反应的化学方程式为3NO2+H2O=2HNO3+NO。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加罗常数为NA,下列说法正确的是
A. 常温常压下,11.2L甲烷中舍有的氢原子数为2NA
B. 标准状况下,19.2g二氧化硫中含有的氧原子数为0.3NA
C. 1molNa被完全氧化生成Na202,转移电子的数目为NA
D. 常温下,1L0.1mol/L MgCl2溶液中含Cl-数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列说法不正确的是 ( )
A. NO2溶于水时发生氧化还原反应
B. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
C. NO可用于某些疾病的治疗
D. NO2与水的反应:3NO2+H2O===2NO![]() +NO↑+2H+
+NO↑+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,A与B反应可生成C和D,其能量变化如图:

(1)下列有关反应A+B===C+D的说法正确的是________。
A.反应前后原子的种类和数目一定不变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需要加热反应就一定能自发进行
D.反应物的总质量、总能量与反应产物的总质量、总能量均相等
(2)若H1<H2,则反应产物的总能量________(填“>”“<”或“=”)反应物的总能量,反应热Q________0(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【宣城市2017届第二次调研测试】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):
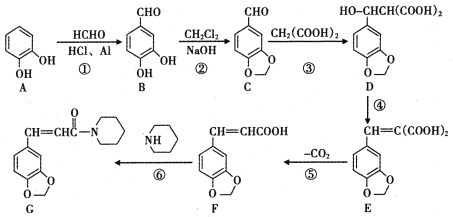
(1)A中含氧官能团名称是____;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 硫化氢在空气中燃烧 D. 高温煅烧硫铁矿
(2)装置C的作用是______________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、________、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(4)①写出SO2与FeCl3溶液反应的离子方程式:______________________________;
②请设计实验方案检验反应后A中Fe2+生成______________________________;
③本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Ca、Sr、Ba是按原子序数由小到大的顺序排列的第ⅡA族元素。已知:①Mg(OH)2难溶于水,而Ca(OH)2微溶于水;②MgSO4溶于水,而CaSO4微溶于水。下列推测中,不正确的是( )。
A. Sr(OH)2溶解于水 B. SrSO4易溶于水
C. BaSO4不溶于水 D. Ba(OH)2比Ca(OH)2更易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com