
【题目】设阿伏加罗常数为NA,下列说法正确的是
A. 常温常压下,11.2L甲烷中舍有的氢原子数为2NA
B. 标准状况下,19.2g二氧化硫中含有的氧原子数为0.3NA
C. 1molNa被完全氧化生成Na202,转移电子的数目为NA
D. 常温下,1L0.1mol/L MgCl2溶液中含Cl-数为0.1NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】只给出下列甲中和乙中对应的量,不能组成一个求物质的量浓度公式的是
序号 | ① | ② | ③ | ④ | ⑤ |
甲 | 物质微粒数 | 标准状况下 气体摩尔体积 | 溶质Na2SO4的质量 | 溶质KCl的 质量分数 | 非标准状况 下物质的质量 |
乙 | 阿伏加德罗常数 | 标准状况下 气体密度 | 溶液的体积 | 溶液的密度 | 物质的摩尔质量 |
A. ①②⑤ B. ①②④⑤ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0 mL于锥形瓶,加入10.0 mL KI溶液(足量),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1的Na2S2O3标准液,调整液面。记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3![]() 2NaI+Na2S4O6(Na2S4O6溶液为无色)。
2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是________ 。
(2)步骤①反应的离子方程式是________ 。
(3)步骤③当待测液由________ 色变为________色且30 s不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为________。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度________ (填“偏大”“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度______(填“偏大”“偏小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

(1)铅蓄电池放电时,PbO2作_______极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。
①根据图l写出过程I的离子方程式:____。
② 生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii.__________________________________________(请你提出一种合理解释)。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是__________________。(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
(4)过程Ⅲ,将PbO粗品溶解在HCI和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。阴极的电极反应式是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法正确的是( )

A. 实验时冷却水应从a进入,从b流出
B. 蒸馏烧瓶中要加入碎瓷片,目的是防止暴沸
C. 锥形瓶中能收集到高浓度的氯化钠溶液
D. 该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列观点正确的是( )
A.含有离子键的物质一定是离子化合物
B.同素异形体之间的转化是物理变化
C.含有共价键的物质一定是共价化合物
D.常温常压下为气态的物质,其微粒间一定存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去。A是一种碳酸氢盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味气体。
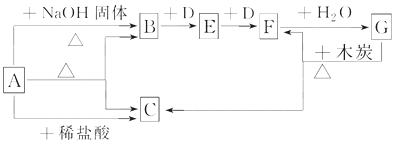
回答下列问题:
(1)物质A的名称是________________。
(2)写出物质B的一种主要用途______________。
(3)写出实验室制取气体B的化学方程式__________________________。
写出工业上制取气体B的化学方程式__________________________。
(4)写出反应的化学方程式:
B→E______________________________。
F→G____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.6 g Na2CO3固体溶于水配成100 mL溶液。
(1) Na2CO3的摩尔质量为__________g/mol。
(2) Na2CO3的物质的量为____________mol。
(3)该溶液中Na2CO3的物质的量浓度为________ mol/L。
(4)从该溶液中取出10 mL,其中含Na+的物质的量为________ mol。
(5)取出的10 mL该溶液加水稀释,稀释后溶液中Na2CO3的物质的量浓度为0.1 mol/L,稀释后溶液体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分某化学兴趣小组在实脸室模拟侯德榜制碱法制备纯碱。主要步骤如下:
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 .
(2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (用离子符号表示)。
(3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com