
【题目】在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在2s时体系内的压强为开始时的1.1倍
C.在平衡时体系内N2O4的物质的量为0.25mol
D.平衡时,N2O4的转化率为40%
【答案】B
【解析】
A.2s时NO2的浓度为0.02mol/L,则转化的N2O4的浓度为0.01mol/L,则前2s以N2O4的浓度变化表示的平均反应速度为![]() =0.005mol·L-1·s-1,故A错误;
=0.005mol·L-1·s-1,故A错误;
B.2s时NO2的物质的量为5L×0.02mol/L=0.1mol,由![]() ,可知消耗的N2O4为0.05mol,故2s时N2O4的物质的量为0.5mol-0.05mol=0.45mol,反应前后的物质的量之比等于压强之比,则在2s时体系内的压强为开始时的
,可知消耗的N2O4为0.05mol,故2s时N2O4的物质的量为0.5mol-0.05mol=0.45mol,反应前后的物质的量之比等于压强之比,则在2s时体系内的压强为开始时的![]() =1.1倍,故B正确;
=1.1倍,故B正确;
C.设转化的N2O4的物质的量为x,则平衡时N2O4的物质的量为0.5molx,NO2的物质的量为2x,由平衡时容器内压强为开始时的1.6倍,则![]() =1.6,解得x=0.3mol,故C错误;
=1.6,解得x=0.3mol,故C错误;
D.N2O4的转化率为![]() =60%,故D错误;
=60%,故D错误;
故选:B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)常温下,铁制器皿__(填能或不能)存放浓硫酸,是因为__。
(2)Fe2O3与铝粉的混合物称为__,该混合物反应的化学方程式为__;若有1molAl反应,则转移__mol电子。
(3)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为__;检验腐蚀后的溶液中是否含有Fe3+的方法是__,从腐蚀废液回收得到金属铜,还需要的试剂是__、__;将铜分离出来的操作是___。
(4)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①外围电子构型为nsnnpn的原子形成的化合物的种类最多
②在硫酸铜溶液中加入过量氨水最后生成深蓝色溶液
③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致
④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e﹣稳定结构
⑤乙醇分子中只含σ键.
A.①③⑤B.③④C.①②⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8、PtNi20等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或“非晶体”)。区分晶体和非晶体最可靠的方法是对固体进行___实验。
(2)实验证明,PtCl2(NH3)2的结构有两种:A呈棕黄色,有抗癌活性,在水中的溶解度为0.258g;B呈淡黄色,无抗癌活性,在水中的溶解度为0.037g。试推测PtCl2(NH3)2的空间构型是__(填“四面体形”或“平面四边形”);请画出A的结构图示___。
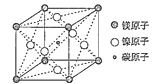
(3)据报道只含镁、镍和碳三种元素的晶体具有超导性,该晶体的晶胞结构如图所示,写出该晶体的化学式__。晶体中每个镁原子周围距离最近的镍原子有__个。
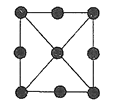
(4)金属铂立方晶体的二维投影图如图所示。若金属铂的密度为dgcm-3,设阿伏加德罗常数的值为NA,则晶胞参数a=__pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )

A. 0.5% B. 1.0% C. 0.1% D. 1.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学设计实验,制备(NH4)2Fe(SO4)26H2O并探究其分解规律。实验步骤如下:
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)26H2O。
V.将(NH4)2Fe(SO4)26H2O脱水得(NH4)2Fe(SO4)2,并进行热分解实验。
已知在不同温度下FeSO47H2O的溶解度如表:
温度(℃) | 1 | 10 | 30 | 50 |
溶解度(g) | 14.0 | 17.0 | 25.0 | 33.0 |
回答下列问题:
(1)步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是__,步骤Ⅱ中设计铁粉过量,是为了__,加热反应过程中需不断补充蒸馏水的目的是__。
(2)步骤Ⅲ中称量反应后剩余铁粉的质量,是为了__。
(3)(NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。

①检验气态产物中的SO2和SO3时,装置连接顺序依次为__(气流从左至右);C中盛放的试剂为__。
②装置A的作用是__。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
N≡N | O=O | N-N | N-H | O-H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol﹣1 。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:
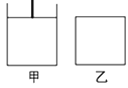
起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列法正确的是________。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________。
A. 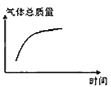 B.
B.  C.
C. 
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______(用A、B、C表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中每一序号分别代表一种元素。
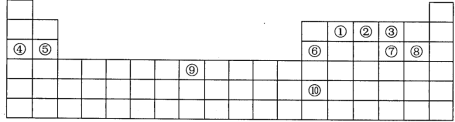
(1)元素⑥的元素名称是__。元素⑤位于元素周期表__区。
(2)元素①原子的价电子数是__。元素⑨在元素周期表的第四周期第__族。
(3)在元素①、②、③中,非金属性最强的是__(用所对应的元素符号表示,下同),第一电离能最大的是__。元素③、⑦、⑧的简单离子的半径由大到小的顺序为__(请填序号,不要加任何连接符号)。
(4)元素⑩的单质可能具有的性质是__(填字母)。
a.能导电导热 b.能与稀盐酸反应生成氢气 c.其晶体属离子晶体
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是__(填化学式)。
在元素①~⑩的最高价氧化物的水化物中,酸性最强的是__(填化学式)。
(6)元素⑨原子的外围电子排布为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请填空:
(1)反应①的K1表达式是___。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
(3)能判断反应③一定处于化学平衡状态的依据是___(填写字母序号)。
A.压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.单位时间内生成H2和H2O(g)的物质的量相等
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
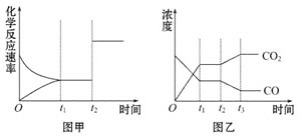
①图甲中t2时刻发生改变的条件是___。
②图乙中t2时刻发生改变的条件是__。
(5)一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向__移动(填“不”、“逆反应方向”或“正反应方向”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com