
����Ŀ������һ�ָ���ȼ�ϡ���֪�����ۼ�����(���ѻ��γ�1mol���ۼ�ʱ���ջ��ͷŵ�����)�����
N��N | O=O | N-N | N-H | O-H | |
����(KJmol��1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol��1 ��
(2)�ܱ������н��з�Ӧ��3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H��0��Ӧ�Ļ�ѧƽ�����ʽΪK=________��
Fe3O4(s)+4H2(g) H��0��Ӧ�Ļ�ѧƽ�����ʽΪK=________��
(3)��֪��600��ʱ��������Ӧ��ƽ�ⳣ��K=16��������ͼ��(���º�ѹ)����ͼ��(���º���)��������
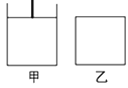
��ʼʱ���±���ʾ�ֱ��������ʣ����Ϊ2L����600��ʱ��Ӧ����һ��ʱ������ƽ�⡣
Fe | H2O(g) | Fe3O4 | H2 | |
��/mol | 2.0 | 1.0 | 2.0 | 0.5 |
��/mol | 2.0 | 2.0 | 2.0 | 1.0 |
�ٹ��ڼס������������з���ȷ����________��
A.��Ӧ��ʼʱ�������ڵ��淴Ӧ���ʣ��ף���
B.����������������ܶȲ��ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
C.���������������ѹǿ���ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
D.ƽ�������Fe3O4���������ڵ�ƽ��������ƶ�
��Ͷ�Ϻ��5min��ƽ�⣬��˶�ʱ���ڵ�ƽ����Ӧ����v(H2)=________��
��ƽ���������������ϵ�¶�ͻȻ����100����ͼ��������ȷ��ӳƽ���ƶ������������ڱ仯�������________��
A. 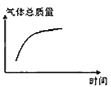 B.
B. 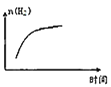 C.
C. 
(4)��ͼΪ���ݾ���������

����������Ӧ����ʼ��ƽ��ʱ�ĸ����ʵ���������
Fe | H2O(g) | Fe3O4 | H2 | |
��ʼ/mol | 3.0 | 3.0 | 0 | 0 |
ƽ��/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
���ڴﵽƽ�����������У��ֱ�������A��B��C��������������Ӹ����ʣ����ٴδ�ƽ��ʱ����������H2�İٷֺ������ɴ�С��˳��______(��A��B��C��ʾ)��
���𰸡�583 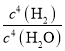 AB 0.05molL-1min1 B B>C>A
AB 0.05molL-1min1 B B>C>A
��������
��1������ͼ�����ݣ����Կ���N2H4(g)+O2(g)![]() N2(g)+2H2O��Ӧ���ʱ���ھɼ��������յ��������¼������ͷŵ�����֮�����H=(154+391��4+497946463��4)kJ/mol=583kJ/mol���ʴ�Ϊ��583��
N2(g)+2H2O��Ӧ���ʱ���ھɼ��������յ��������¼������ͷŵ�����֮�����H=(154+391��4+497946463��4)kJ/mol=583kJ/mol���ʴ�Ϊ��583��
��2����ѧƽ�����ʽΪK= ��
��
��3����A����Ӧ��ʼʱ��������H2��Ũ�Ƚϴ������淴Ӧ���ʣ���<�ң�����ȷ��
B��ˮ�������ܶ����������ܶȲ�ͬ�����Ե������ڵ��ܶȲ���ʱ������ƽ��״̬������ȷ��
C���÷�ӦΪ�����������ķ�Ӧ������������ѹǿʼ�ղ��䣬������ѹǿ�ж�ƽ��״̬���ʴ���
D��ƽ�������Fe3O4�����ӹ������ƽ�ⲻ�ƶ����ʴ���
��ѡAB��
��Ͷ�Ϻ��5min��ƽ�⣬��˶�ʱ���ڵ�ƽ����Ӧ����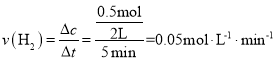 ���ʴ�Ϊ��0.05molL-1min1��
���ʴ�Ϊ��0.05molL-1min1��
�۷�Ӧ�Ƿ��ȷ�Ӧ������ƽ����ϵ�¶Ƚ���100����ƽ�������ƶ���
A�������ƶ�H2Oת��Ϊ�����ʵ�����H2������������С����A�����ϣ�
B��ƽ�������ƶ����������ʵ�������B���ϣ�
C����Ӧǰ���������������仯���ܶ��淴Ӧ���з����仯����C�����ϣ�
�ʴ�Ϊ��B��
��4�����ڷ�Ӧǰ�����������ȣ�����C�����£�ƽ�ⲻ�ƶ������������������ƽ������ͬ��A״���£���Ӧ�������������������Ӧ�ų�����ʹ�����¶����ߣ����Ʒ�Ӧ����������������������������ϵͣ�B״���·�Ӧ�����������Fe��ˮ�������ȹ��̣�ʹ�����¶Ƚ��ͣ����Ʒ�Ӧ��������������������������������ϸߣ���H2�İٷֺ������ɴ�С��˳�����У�B>C>A��
�ʴ�Ϊ��B>C>A��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������²���ɴ�![]() �ϳ�
�ϳ�![]() (�����Լ��з�Ӧ��������ȥ)��
(�����Լ��з�Ӧ��������ȥ)��
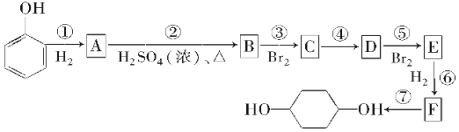
��ش��������⣺
��1��д��E�Ľṹ��ʽ��___��B���п�������̼ԭ�ӹ���___�����ǻ��
��2����Ӧ�١�����������ȥ��Ӧ����___������ȡ����Ӧ����___��
��3����д��A��B��Ӧ�Ļ�ѧ����ʽ��___��C��D��Ӧ�Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ж�����ڳ���ѹ�����;�����γ���ṹ���о�������NaCl������50��300GPa�ĸ�ѹ�º�Na��Cl2��Ӧ�������γɲ�ͬ��ɡ���ͬ�ṹ�ľ��塣��ͼ�����������־���ľ���������Ϊ��ԭ�ӣ�С��Ϊ��ԭ�ӣ������������־�����˵����ȷ���ǣ� ��
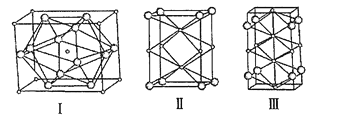
A.����������ԭ�ӵ���λ��Ϊ12
B.�������к���6����ԭ��
C.����������Ӧ����Ļ�ѧʽΪNa2Cl
D.���־��������NaCl������50��300GPa�ĸ�ѹ�º�Na��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100��ʱ����0.5molN2O4ͨ�����Ϊ5L������ܱ������У��������ֺ���ɫ����Ӧ���е�2sʱ��NO2��Ũ��Ϊ0.02mol��L-1����60sʱ����ϵ�Ѵ�ƽ�⣬��ʱ������ѹǿΪ��ʼʱ��1.6 ��������˵����ȷ����
A.ǰ2s��N2O4��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol��L-1��s-1
B.��2sʱ��ϵ�ڵ�ѹǿΪ��ʼʱ��1.1��
C.��ƽ��ʱ��ϵ��N2O4�����ʵ���Ϊ0.25mol
D.ƽ��ʱ��N2O4��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO3)�Ƕ�Ԫ����,��������Ҫ������������,���Na2HPO3��ҺҲ�ɵõ�������,װ��ʾ��ͼ��ͼ(������Ĥֻ����������ͨ��,��Ĥֻ����������ͨ��)������˵������ȷ����

A. �����ĵ缫��ӦʽΪ2H2O-4e-![]() 4H++O2��
4H++O2��
B. ��Ʒ���з��������ӷ�ӦΪHPO32-+2H+![]() H3PO3
H3PO3
C. ԭ������Na+Ũ�ȱ��ֲ���
D. ����������Һ��pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����³����(���ӽṹ���ϳ���·)���п������ԣ���һ�ֺϳ�·����ͼ��
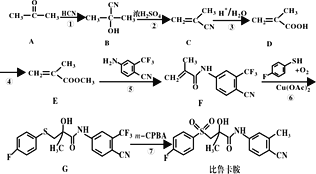
�ش���������
��1��A�Ļ�ѧ����Ϊ__��
��2��D�й����ŵ�������__��
��3����Ӧ�������Լ��������ֱ�Ϊ__��__��
��4��д���ݵķ�Ӧ����ʽ__��
��5��F�ķ���ʽΪ__��
��6��д����E��Ϊͬ���칹�壬�ҷ������������Ļ�����Ľṹ��ʽ__��
�����������������E��ͬ���ں˴Ź�������Ϊ����壬�������Ϊ1��1��6
��7���ο���³�����ϳɵ������Ϣ�������ͼ�ϳ���·(�����Լ���ѡ)___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2010��10��5��17ʱ45�֣����ʼҿ�ѧԺ��������2010��ŵ��������ѧ������Ӣ������˹�ش�ѧ��ѧ�Ұ����ҡ���ķ�Ϳ�˹̹����ŵ��Ф����Ա���������ʯīϩ���Ϸ����Խ�о���ʯīϩ��Ŀǰ�Ƽ��о����ȵ㣬�ɿ�����ʯī�IJ�״�ṹһ��һ��İ����õ��ĵ���̼ԭ�ӣ��ṹ��ͼ��ʾ�������������뵽ʯīϩ�п�����һ�־���ͻ���Ե��²���ʯī�飬����˵������ȷ���ǣ� ��

A.ʯīϩ�Ǹ߷��ӻ�����
B.ʯīϩ��ʯī�黥Ϊͬ��������
C.һ��������ʯīϩ����H2�����ӳɷ�Ӧ
D.���ݽṹʾ��ͼ��֪��ʯīϩ���ܵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���SiO2ϸ�۷�������ˮ�У�������ƽ�⣬����H4SiO4��Һ��SiO2+2H2OH4SiO4�����÷�Ӧƽ�ⳣ��K���¶ȵı仯��ͼʾ������1Сʱ�����H4SiO4����������Ϊ0.01%����Һ�ܶ�Ϊ1.0g/mL�������з�����ȷ���ǣ�������
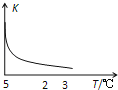
A.�÷�Ӧƽ�ⳣ���ı���ʽΪK=c��H4SiO4��
B.������H4SiO4�ķ�ӦΪ���ȷ�Ӧ
C.��H4SiO4��ʾ�ķ�Ӧ����Ϊ1.04��10��2mol/��Lh��
D.��Kֵ�����ƽ���ƶ�ʱ�淴Ӧ�����ȼ�С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���õ����ָʾ����̪�Ľṹ��ʽ��ͼ��ʾ�����й��ڷ�̪��˵��������ǣ� ��
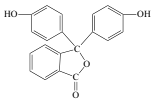
A.��̪�ķ���ʽΪC20H14O4
B.��̪���������ԣ������ڷ����廯����
C.1mol��̪�����2molNaOH������Ӧ
D.��̪�ڼ����������ܹ�����ˮ�ⷴӦ�����ֺ�ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com