
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂盒反应条件已略去):
(部分试剂盒反应条件已略去):
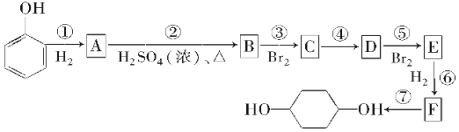
请回答下列问题:
(1)写出E的结构简式:___,B中有可能所有碳原子共面___(填是或否)。
(2)反应①~⑦中属于消去反应的是___,属于取代反应的是___。
(3)试写出A→B反应的化学方程式:___,C→D反应的化学方程式:___。
【答案】![]() 否 ②④ ⑦
否 ②④ ⑦ ![]()
![]()
![]() +H2O
+H2O ![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O
+2NaBr+2H2O
【解析】
与氢气发生加成反应生成A,A为![]() ,A在浓硫酸、加热条件下发生消去反应生成B,则B为
,A在浓硫酸、加热条件下发生消去反应生成B,则B为![]() ,B与溴发生加成反应生成C,则C为
,B与溴发生加成反应生成C,则C为![]() ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为 ![]() ,D与溴发生1,4-加成生成E,E为
,D与溴发生1,4-加成生成E,E为![]() ,E与氢气发生加成反应生成F,F为
,E与氢气发生加成反应生成F,F为![]() ,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为
,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为![]() ,据此分析。
,据此分析。
与氢气发生加成反应生成A,A为![]() ,A在浓硫酸、加热条件下发生消去反应生成B,则B为
,A在浓硫酸、加热条件下发生消去反应生成B,则B为![]() ,B与溴发生加成反应生成C,则C为
,B与溴发生加成反应生成C,则C为![]() ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为 ![]() ,D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,F为
,D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,F为![]() ,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为
,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为![]() 。
。
(1)E的结构简式为![]() ,B为
,B为![]() ,根据烯烃及环烷的结构可知,不可能所有碳原子共面;
,根据烯烃及环烷的结构可知,不可能所有碳原子共面;
(2)反应①③⑤⑥属于加成反应,反应②④属于消去反应,反应⑦属于取代反应,反应⑧属于缩聚反应,故答案为:②④;⑦;
(3)A→B为![]() 在浓硫酸、加热条件下发生消去反应生成
在浓硫酸、加热条件下发生消去反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为![]()
![]()
![]() +H2O;
+H2O;
C→D是![]() 在氢氧化钠醇溶液、加热条件下发生消去反应生成
在氢氧化钠醇溶液、加热条件下发生消去反应生成![]() 、溴化钠和水,反应的化学方程式为
、溴化钠和水,反应的化学方程式为![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O。
+2NaBr+2H2O。


科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.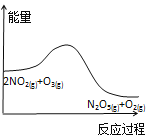 降低温度,平衡向正反应方向移动
降低温度,平衡向正反应方向移动
B. 0-3s内,反应速率v(NO2)=0.2mol·L-1
0-3s内,反应速率v(NO2)=0.2mol·L-1
C.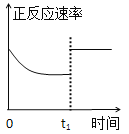 t1时仅加入催化剂,平衡正向移动
t1时仅加入催化剂,平衡正向移动
D.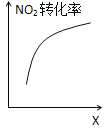 达到平衡时,仅改变X,则X为c(O2)
达到平衡时,仅改变X,则X为c(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A分子的立体结构图(其中C、H原子已去):因其分子中碳原子排列类似金刚石故名“金刚烷”,下列错误的是()
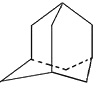
A. 金刚烷分子式是C10H16
B. 金刚烷分子的二氯代物有4种
C. 金刚烷分子中有4个六元环组成
D. 金刚烷分子的一氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)常温下,铁制器皿__(填能或不能)存放浓硫酸,是因为__。
(2)Fe2O3与铝粉的混合物称为__,该混合物反应的化学方程式为__;若有1molAl反应,则转移__mol电子。
(3)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为__;检验腐蚀后的溶液中是否含有Fe3+的方法是__,从腐蚀废液回收得到金属铜,还需要的试剂是__、__;将铜分离出来的操作是___。
(4)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示,下列说法正确的是( )
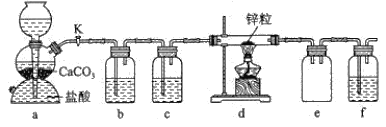
A.实验开始时,先点燃酒精灯,后打开活塞K
B.a中所发生反应的离子方程式是CO32-+2H+=CO2↑+H2O
C.b、c、f中试剂依次为饱和碳酸氢钠溶液、浓硫酸、银氨溶液
D.装置e的作用是收集一氧化碳气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀的说法正确的是( )
A. 金属在潮湿空气中腐蚀的实质是M+nH2O=M(OH)n+![]() H2↑
H2↑
B. 金属的化学腐蚀的实质是M-ne-=Mn+,电子直接转移给氧化剂
C. 金属的化学腐蚀必须在酸性条件下进行
D. 在潮湿的环境中,金属的电化学腐蚀一定是析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下图判断,下列叙述正确的是( )

A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①外围电子构型为nsnnpn的原子形成的化合物的种类最多
②在硫酸铜溶液中加入过量氨水最后生成深蓝色溶液
③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致
④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e﹣稳定结构
⑤乙醇分子中只含σ键.
A.①③⑤B.③④C.①②⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
N≡N | O=O | N-N | N-H | O-H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol﹣1 。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:
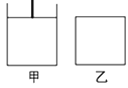
起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列法正确的是________。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________。
A. 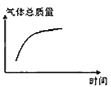 B.
B.  C.
C. 
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______(用A、B、C表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com