
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示,下列说法正确的是( )
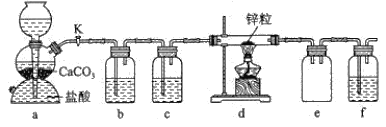
A.实验开始时,先点燃酒精灯,后打开活塞K
B.a中所发生反应的离子方程式是CO32-+2H+=CO2↑+H2O
C.b、c、f中试剂依次为饱和碳酸氢钠溶液、浓硫酸、银氨溶液
D.装置e的作用是收集一氧化碳气体
【答案】C
【解析】
探究CO2和锌粒反应是否生成CO,a装置是二氧化碳气体发生装置,生成的二氧化碳气体含有氯化氢和水蒸气,通过b中饱和碳酸氢钠溶液除去氯化氢,装置c中浓硫酸除去水蒸气,通过 d加热和锌发生反应,装置e为安全瓶,f装置进行尾气处理。
A.实验开始时,需先打开活塞K,使反应产生的CO2排尽装置内空气,避免空气与锌粉反应,后点燃酒精灯,故A错误;
B.a装置是二氧化碳气体发生装置,由盐酸和碳酸钙反应生成,离子方程式为CaCO3+2H+═CO2↑+Ca2++H2O,故B错误;
C.b装置是除去CO2中的氯化氢,可用饱和碳酸氢钠溶液,吸收氯化氢的同时产生CO2,c装置中用浓硫酸除去水蒸气,f装置进行尾气处理,根据题目信息可知银氨溶液可以吸收CO,故C正确;
D.装置e为安全瓶,防止装置f中的液体倒吸到硬质玻璃管中,故D错误;
故选C。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学用语的表示正确的是( )
A.N原子的最外层电子轨道表示式: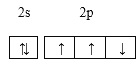
B.质子数为35、中子数为45的溴原子:![]() Br
Br
C.硫离子的结构示意图:![]()
D.间二甲苯的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,进行如下实验:
①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水,
②用质谱仪测定其相对分子质量,得到如图所示的质谱图。
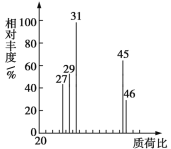
试回答下列问题:
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)能否根据A的实验式确定其分子式?____(填“能”或“不能”,并对应回答后面问题)。若能,则A的分子式是________,若不能,请说明原因:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酰对苯二胺(商品名“凯夫拉”)制成的材料具有密度低、强度高和耐高温的特点,可用于生产防弹衣。合成凯夫拉的一种方法如下:
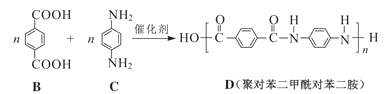 +(2n-1)H2O
+(2n-1)H2O
请回答下列问题:
(1)A的分子式为_________。![]() 的同系物
的同系物![]() 的化学名称是___________。
的化学名称是___________。
(2)B的含氧官能团是_________。![]() 的核磁共振氢谱有_____组(个)吸收峰。
的核磁共振氢谱有_____组(个)吸收峰。
(3)![]() 的反应属于_______(填“加聚”或“缩聚”)反应。
的反应属于_______(填“加聚”或“缩聚”)反应。
(4)符合下列条件的B的同分异构体有____种(不包含![]() )。
)。
①含有苯环 ②与![]() 的官能团种类和数目完全相同
的官能团种类和数目完全相同
(5)合成路线中E的结构简式为______,生成![]() 的化学方程式为__________________。
的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应。
(1)该反应的化学方程式是__。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
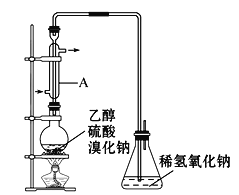
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
已知反应物的用量:0.3molNaBr(s);0.25mol乙醇(密度为0.80g·mL-1);36mL硫酸。
请回答下列问题。
(2)仪器A最好更改为___。
(3)反应时若温度过高,则有SO2生成,同时观察到还有一种红棕色气体产生。反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的__。
a.饱和食盐水 b.稀氢氧化钠溶液 c.乙醇 d.四氯化碳
(4)本实验的产率为80%,则可制取溴乙烷___g。
(5)写出由溴乙烷合成乙二醇的路线___。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
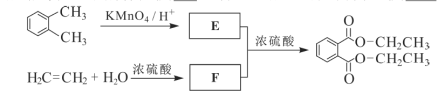
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂盒反应条件已略去):
(部分试剂盒反应条件已略去):
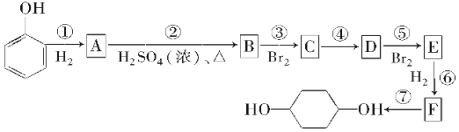
请回答下列问题:
(1)写出E的结构简式:___,B中有可能所有碳原子共面___(填是或否)。
(2)反应①~⑦中属于消去反应的是___,属于取代反应的是___。
(3)试写出A→B反应的化学方程式:___,C→D反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
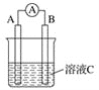
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是

A. 阳极的电极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com