
【题目】下列说法中正确的是( )
①外围电子构型为nsnnpn的原子形成的化合物的种类最多
②在硫酸铜溶液中加入过量氨水最后生成深蓝色溶液
③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致
④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e﹣稳定结构
⑤乙醇分子中只含σ键.
A.①③⑤B.③④C.①②⑤D.⑤
【答案】C
【解析】
①外围电子构型为nsnnpn,则n=2,即为C元素,C元素形成有机物,种类最多;②在硫酸铜溶液中加入过量氨水生成[Cu(NH3)4]2+;③H2O的稳定性与共价键的强弱有关,与氢键无关;④根据原子结构及成键情况,BF3中的B原子最外层有6个e﹣、CH3Cl中的H原子有2个e﹣,最外层不满足8e﹣稳定结构;⑤单键为σ键。
①外围电子构型为nsnnpn,则n=2,为C元素,C元素形成有机物,种类最多,正确;②在硫酸铜溶液中加入过量氨水生成[Cu(NH3)4]2+,溶液为深蓝色,正确;③H2O的稳定性与共价键的强弱有关,与氢键无关,错误;④P BF3中的B原子最外层有6个e﹣、CH3Cl中的H原子有2个e﹣,最外层不满足8e﹣稳定结构,故错误;⑤单键为σ键,乙醇的结构式为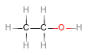 ,只含σ键,正确;
,只含σ键,正确;
故选C。


科目:高中化学 来源: 题型:
【题目】下列各组有机物中,无论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗的氧气及生成的水的物质的量也不变的是
A.C2H2和C6H6
B.C2H6和C2H5OH
C.C2H4和C2H6O
D.C6H6和C7H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂盒反应条件已略去):
(部分试剂盒反应条件已略去):
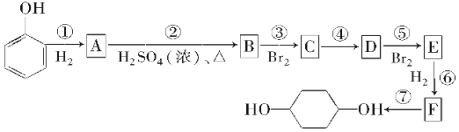
请回答下列问题:
(1)写出E的结构简式:___,B中有可能所有碳原子共面___(填是或否)。
(2)反应①~⑦中属于消去反应的是___,属于取代反应的是___。
(3)试写出A→B反应的化学方程式:___,C→D反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗a mol A,同时生成3a mol CB.容器内B的浓度不再变化
C.混合气体的物质的量不再变化D.A的消耗速率等于C的生成速率的![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
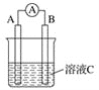
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛,Ni的基态原子有________种能量不同的电子;很多不饱和有机物在Ni催化下可以H2发生加成反应,如①CH2═CH2、②HC≡CH、③ ![]() 、④HCHO等,其中碳原子不是采取sp2杂化的分子有________(填物质编号),HCHO分子的立体构型为________
、④HCHO等,其中碳原子不是采取sp2杂化的分子有________(填物质编号),HCHO分子的立体构型为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl晶体在50~300GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体。如图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子),关于这三种晶胞的说法正确的是( )
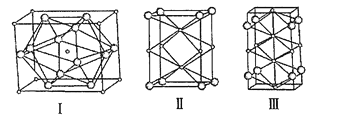
A.晶胞Ⅰ中钠原子的配位数为12
B.晶胞Ⅱ中含有6个钠原子
C.晶胞Ⅲ所对应晶体的化学式为Na2Cl
D.三种晶体均是由NaCl晶体在50~300GPa的高压下和Na反应所得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在2s时体系内的压强为开始时的1.1倍
C.在平衡时体系内N2O4的物质的量为0.25mol
D.平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2OH4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
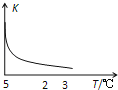
A.该反应平衡常数的表达式为K=c(H4SiO4)
B.该生成H4SiO4的反应为吸热反应
C.用H4SiO4表示的反应速率为1.04×10﹣2mol/(Lh)
D.若K值变大,在平衡移动时逆反应速率先减小后增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com