
【题目】室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2OH4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
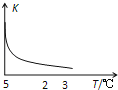
A.该反应平衡常数的表达式为K=c(H4SiO4)
B.该生成H4SiO4的反应为吸热反应
C.用H4SiO4表示的反应速率为1.04×10﹣2mol/(Lh)
D.若K值变大,在平衡移动时逆反应速率先减小后增大
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①外围电子构型为nsnnpn的原子形成的化合物的种类最多
②在硫酸铜溶液中加入过量氨水最后生成深蓝色溶液
③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致
④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e﹣稳定结构
⑤乙醇分子中只含σ键.
A.①③⑤B.③④C.①②⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
N≡N | O=O | N-N | N-H | O-H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol﹣1 。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:
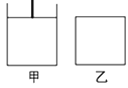
起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列法正确的是________。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________。
A. 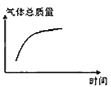 B.
B. 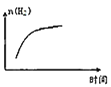 C.
C. 
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______(用A、B、C表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中每一序号分别代表一种元素。
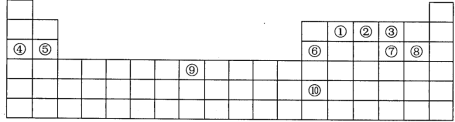
(1)元素⑥的元素名称是__。元素⑤位于元素周期表__区。
(2)元素①原子的价电子数是__。元素⑨在元素周期表的第四周期第__族。
(3)在元素①、②、③中,非金属性最强的是__(用所对应的元素符号表示,下同),第一电离能最大的是__。元素③、⑦、⑧的简单离子的半径由大到小的顺序为__(请填序号,不要加任何连接符号)。
(4)元素⑩的单质可能具有的性质是__(填字母)。
a.能导电导热 b.能与稀盐酸反应生成氢气 c.其晶体属离子晶体
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是__(填化学式)。
在元素①~⑩的最高价氧化物的水化物中,酸性最强的是__(填化学式)。
(6)元素⑨原子的外围电子排布为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol过氧化钠与2mol碳酸氢钠固体混合,在密闭容器中,120℃充分反应后,排出气体,冷却,有固体残留.下列分析正确的是( )
A.残留固体是2mol Na2CO3
B.残留固体是 Na2CO3和NaOH的混合物
C.反应中转移2mol电子
D.排出的气体是1.5mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
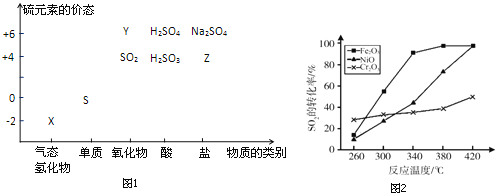
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.Ag2CO3的Ksp为8.1×10-12
B.Ag2CO3(s)+2Cl-(aq)![]() 2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
C.向Ag2CO3的饱和溶液中加入K2CO3(s),可使c(CO32-)增大(由Y点到X点)
D.向同浓度的KCl和K2CO3的混合溶液中滴入0.001mol·L-1AgNO3溶液,CO32-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请填空:
(1)反应①的K1表达式是___。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
(3)能判断反应③一定处于化学平衡状态的依据是___(填写字母序号)。
A.压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.单位时间内生成H2和H2O(g)的物质的量相等
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
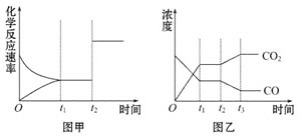
①图甲中t2时刻发生改变的条件是___。
②图乙中t2时刻发生改变的条件是__。
(5)一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向__移动(填“不”、“逆反应方向”或“正反应方向”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是
A.较浓盐酸可有效抑制Fe3+水解
B.稀释过程中FeCl3水解程度增大,c(H+)增大
C.FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+
D.FeCl3溶液显黄色,没有Fe(OH)3存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com