
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗a mol A,同时生成3a mol CB.容器内B的浓度不再变化
C.混合气体的物质的量不再变化D.A的消耗速率等于C的生成速率的![]() 倍
倍
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期第ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
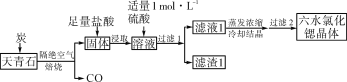
已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10
③SrCl2·6H2O的摩尔质量为267 g·mol-1
(1)工业上天青石焙烧前先研磨粉碎,其目的是___
(2)工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有硫元素被还原,转移了3 mol电子。写出该反应的化学方程式____
(3)加入硫酸的目的是_____;为了提高原料的利用率,滤液1中Sr2+的浓度应不高于__________mol·L-1(注:此时滤液1中Ba2+浓度为1×10-5 mol·L-1 )。
(4)滤渣1的主要成分是____________,滤液1经蒸发浓缩、冷却结晶、过滤后,需对所得的六水氯化锶晶体进行洗涤、干燥。证明六水氯化锶晶体已洗涤干净的实验操作及现象为___________
(5)工业上常通过电解熔融SrCl2制锶单质。由SrCl2·6H2O制取氯化锶的方法是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)常温下,铁制器皿__(填能或不能)存放浓硫酸,是因为__。
(2)Fe2O3与铝粉的混合物称为__,该混合物反应的化学方程式为__;若有1molAl反应,则转移__mol电子。
(3)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为__;检验腐蚀后的溶液中是否含有Fe3+的方法是__,从腐蚀废液回收得到金属铜,还需要的试剂是__、__;将铜分离出来的操作是___。
(4)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀的说法正确的是( )
A. 金属在潮湿空气中腐蚀的实质是M+nH2O=M(OH)n+![]() H2↑
H2↑
B. 金属的化学腐蚀的实质是M-ne-=Mn+,电子直接转移给氧化剂
C. 金属的化学腐蚀必须在酸性条件下进行
D. 在潮湿的环境中,金属的电化学腐蚀一定是析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下图判断,下列叙述正确的是( )

A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,加入一定量的一氧化氮和足量碳发生反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示。下列说法正确的是 ( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示。下列说法正确的是 ( )
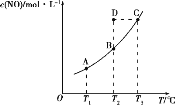
A.在T2时,若反应体系处于状态D,则此时v正<v逆
B.增大NO的物质的量,可以提高NO的平衡转化率
C.若状态B、C、D时体系压强分别为pB、pC、pD,则pC=pD>pB
D.当容器内混合气体密度不变时,反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①外围电子构型为nsnnpn的原子形成的化合物的种类最多
②在硫酸铜溶液中加入过量氨水最后生成深蓝色溶液
③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致
④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e﹣稳定结构
⑤乙醇分子中只含σ键.
A.①③⑤B.③④C.①②⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8、PtNi20等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或“非晶体”)。区分晶体和非晶体最可靠的方法是对固体进行___实验。
(2)实验证明,PtCl2(NH3)2的结构有两种:A呈棕黄色,有抗癌活性,在水中的溶解度为0.258g;B呈淡黄色,无抗癌活性,在水中的溶解度为0.037g。试推测PtCl2(NH3)2的空间构型是__(填“四面体形”或“平面四边形”);请画出A的结构图示___。
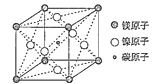
(3)据报道只含镁、镍和碳三种元素的晶体具有超导性,该晶体的晶胞结构如图所示,写出该晶体的化学式__。晶体中每个镁原子周围距离最近的镍原子有__个。
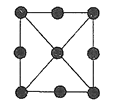
(4)金属铂立方晶体的二维投影图如图所示。若金属铂的密度为dgcm-3,设阿伏加德罗常数的值为NA,则晶胞参数a=__pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中每一序号分别代表一种元素。
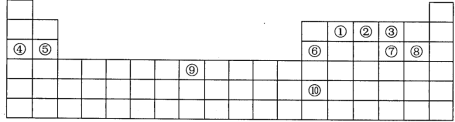
(1)元素⑥的元素名称是__。元素⑤位于元素周期表__区。
(2)元素①原子的价电子数是__。元素⑨在元素周期表的第四周期第__族。
(3)在元素①、②、③中,非金属性最强的是__(用所对应的元素符号表示,下同),第一电离能最大的是__。元素③、⑦、⑧的简单离子的半径由大到小的顺序为__(请填序号,不要加任何连接符号)。
(4)元素⑩的单质可能具有的性质是__(填字母)。
a.能导电导热 b.能与稀盐酸反应生成氢气 c.其晶体属离子晶体
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是__(填化学式)。
在元素①~⑩的最高价氧化物的水化物中,酸性最强的是__(填化学式)。
(6)元素⑨原子的外围电子排布为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com