

| 实验步骤 | 预期现象和结论 |
| 步骤2:往步骤1所得溶液中滴加过量Ba(NO3)2溶液 | 有白色沉淀生成,说明工业碳酸钠含有Na2SO4杂质 |
| 步骤3:将步骤2溶液静置,往上层澄清溶液中滴加 几滴AgNO3溶液 | 有白色沉淀生成,说明工业碳酸钠含有NaCl 杂质 |


科目:高中化学 来源: 题型:
| A、150ml 1mol/LNaCl溶液 |
| B、50ml 3mol/LKClO3溶液 |
| C、25ml 3mol/LKCl溶液 |
| D、75ml 1mol/L FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
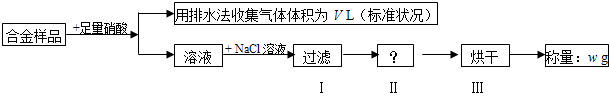
| A、收集到的V L气体全为 NO | ||
| B、过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 | ||
| C、操作Ⅱ应是洗涤 | ||
D、铜的质量分数为:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
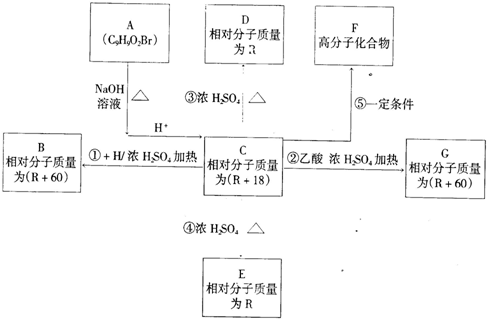
查看答案和解析>>
科目:高中化学 来源: 题型:
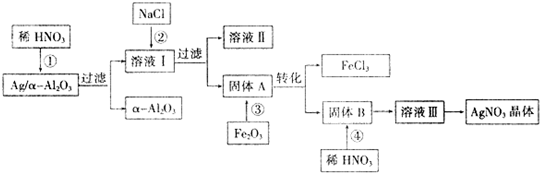
查看答案和解析>>
科目:高中化学 来源: 题型:
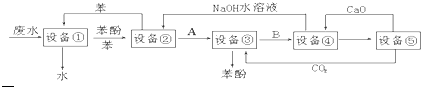
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,淀粉遇I-变蓝色 |
| B、油脂水解可得到高级脂肪酸和甘油 |
| C、在蛋白质溶液中加入CuSO4浓溶液,会使蛋白质发生盐析 |
| D、蔗糖和麦芽糖的组成都是C12H22O11,水解产物都是葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com