

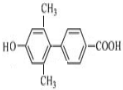
 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| NaOH溶液 |
| CH3COOH |
| 浓硫酸,△ |
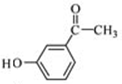 ;
; 发生题中转化关系中的②得
发生题中转化关系中的②得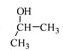 ,
, 再发生类似题中的③④⑤反应,可得
再发生类似题中的③④⑤反应,可得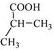 ,再用
,再用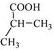 与
与 酯化得
酯化得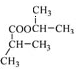 .
. ,
, ,
, ;
;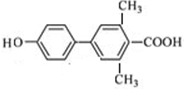 、
、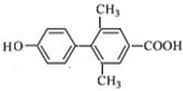 、
、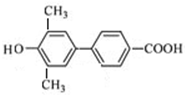 、
、 ,
, 、
、 、
、 、
、 ;
; 发生题中转化关系中的②得
发生题中转化关系中的②得 ,
, 再发生类似题中的③④⑤反应,可得
再发生类似题中的③④⑤反应,可得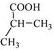 ,再用
,再用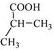 与
与 酯化得
酯化得 ,所以其合成路线为
,所以其合成路线为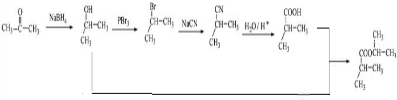 ,
, .
.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、15N 和14N互为同位素 |
| B、13C与C60互为同位素 |
| C、13C与15N有相同的中子数 |
| D、15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g?cm-3 | 0.789 | 1.595 | 0.71~0.76 | 4.93 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、2个 | B、3个 | C、4个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH在常温下Ka数值约为l×101-2a |
| B、约有1.0×l0a-14 mol?L-1的水发生电离 |
| C、加热后溶液pH<a |
| D、加少量水后,溶液pH>a |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.
以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | H2SiO3的酸性比H2CO3的酸性强 |
| B | 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 检验KClO3中的氯元素 |
| C | 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失 | 说明原溶液中一定含有CO32- 或 SO32- |
| D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤 | 除去Mg(OH)2样品中的Ca(OH)2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com