
【题目】据报道,美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点,其电池反应为:2Zn+O2=2ZnO ,其原料为锌、空气和电解质溶液,则下列叙述正确的是
A.锌为正极,空气在负极反应
B.负极还原反应,正极氧化反应
C.负极的电极反应为:Zn-2e-+2OH-=ZnO+H2O
D.电池工作时溶液的pH降低
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I、已知A、B、C、D、E、F、G都是中学化学常见的物质,下图中A为淡黄色固体,B、C为溶液,D、G为无色气体,E、F为白色沉淀。
①写出B→C的离子方程式
②写出D和G反应的化学方程式
③写出过量的D通入Ba(OH)2溶液中的离子方程式
II.由X、Y两种元素组成的离子化合物A。在空气中充分灼烧得到含X元素的16g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得93.2g固体。
(1)在此过程中,消耗5 mol/L的双氧水的体积至少为 。
(2)将A溶于D的稀溶液中生成E,并产生一种单质和一种气体,则该反应的化学方程式 。
(3)将化合物E隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的化学式是_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知铜是29号元素,写出Cu的价层电子排布式________,在元素周期表中的位置______,该元素在________(填“s”“p”“d”“f”或“ds”)区。
(2)写出与N同主族的As的基态原子的价电子排布图:______________。从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为________。
(3)写出Fe2+的核外电子排布式:________。
(4) 下列三种晶体:①CO2,②NaCl,③金刚石,它们的熔点从低到高的顺序____(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图.下列叙述正确的是
2Z影响的示意图.下列叙述正确的是

A.该反应为放热反应
B.增大压强,平衡正向移动
C.X、Y、Z均为气态
D.X和Y中只有一种为气态,Z为气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是
A.一定有碘离子 B.可能含铁离子 C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等。
乙炔法:![]()
丙烯氨氧化法:![]()
(1)下列说法正确的是 (不定项选择):
a.NH4+空间构型呈正四面体
b.CH2=CHCN分子中只有碳、氢原子位于同一平面
c.C2H2、HCN分子中所有原子均位于同一直线
d.NH3极易溶于H2O,是因为它们都是极性分子
(2)与NH3互为等电子体的阳离子为 (写化学式)。
(3)1mol丙烯腈分子中含有![]() 键的数目为 。
键的数目为 。
(4)铜能与浓盐酸缓慢发生置换反应产生氢气,有配合物H[CuCl2]生成。
①该反应的化学方程式为 。
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B. 7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C. 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D. 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
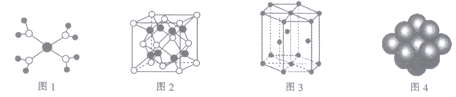
A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
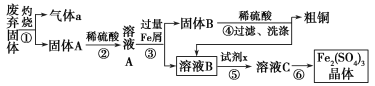
(1)③④操作中会有一种气体生成,若在实验室制备该气体,可选择下列哪些装置________。
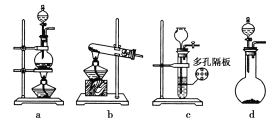
(2)溶液B加稀硫酸酸化后加强氧化剂x,试剂x最好选择下列哪种试剂________(填序号)。
a.Cl2 b.H2O2 c.KMnO4
试剂x在酸性条件下与溶液B反应的离子方程式为_____________________________________。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
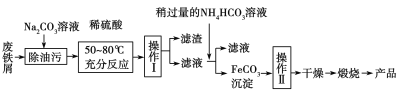
操作II的的名称是 ;
写出在空气中煅烧FeCO3的化学方程式_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com